光致發(fā)光稀土有機(jī)配合物在無(wú)機(jī)/有機(jī)發(fā)光研究交叉領(lǐng)域的進(jìn)展
光致發(fā)光稀土有機(jī)配合物(PhotoluminescenceLanthanide Organic Complex) 作為無(wú)機(jī)發(fā)光、有機(jī)發(fā)光研究的交叉領(lǐng)域,有著**重要的理論意義,同時(shí)有在分析傳感器、生物成像、光子材料等方面的潛在應(yīng)用,因而受到人們的廣泛關(guān)注。
自1942年Weissman次用紫外光激發(fā)β-二酮類Eu3+配合物,觀察到中心離子Eu3+的特征線狀發(fā)射開始,科學(xué)家們**研究稀土離子作為高強(qiáng)度理想發(fā)光體及其應(yīng)用。
如今,作為一類特殊的發(fā)光材料,光致發(fā)光稀土有機(jī)配合物是全彩平板顯示器件中理想的發(fā)光材料之一,具有獨(dú)特的優(yōu)勢(shì)和重要的地位。不僅如此,光致發(fā)光稀土有機(jī)配合物已在工農(nóng)生產(chǎn)和國(guó)防等各個(gè)領(lǐng)域得到了廣泛應(yīng)用,如節(jié)能燈、半導(dǎo)體照明、抗放射涂層、熒光防偽材料、農(nóng)用轉(zhuǎn)光膜等。
由于稀土離子的4f電子層中排列的電子不同以及電子在軌道中排列方式存在差異,使得稀土離子具有非常獨(dú)特的能級(jí)躍遷。
稀土有機(jī)配合物的發(fā)光主要是受激發(fā)配體通過無(wú)輻射分子內(nèi)能量傳遞,將受激發(fā)能量傳遞給中心離子,中心離子發(fā)出特征熒光。稀土離子的這種發(fā)光現(xiàn)象稱為“稀土敏化發(fā)光”。其中,由稀土離子Sm3+、Eu3+、Tb3+、Dy3+和有機(jī)配體所形成的配合物具有較好的發(fā)光性能。在紫外光的激發(fā)下,稀土離子的4f電子層容易發(fā)生4f-4f的電子躍遷,即從基態(tài)接受配體傳遞的能量后過渡到激發(fā)態(tài),發(fā)出熒光后又回到基態(tài),在這個(gè)能量傳遞過程中既有分子內(nèi)能量傳遞,也有分子間能量傳遞。
這一能量傳遞過程見圖1。通常用相鄰強(qiáng)吸收發(fā)色團(tuán)的**能量轉(zhuǎn)移來(lái)刺激稀土離子的發(fā)光,即“天線效應(yīng)(antenna effect) ”。而為了滿足相應(yīng)稀土離子的**敏化條件,有機(jī)發(fā)色團(tuán)的三重態(tài)能量應(yīng)高于或接近稀土離子。
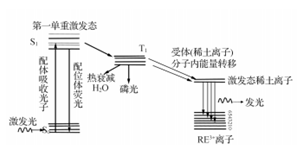
圖 1 稀土有機(jī)發(fā)光配合物分子內(nèi)能量傳遞過程示意圖
稀土有機(jī)配合物在發(fā)光方面主要有熒光壽命較長(zhǎng)、發(fā)射峰狹窄、Stokes位移較大等優(yōu)點(diǎn)。但稀土離子本身自旋禁阻的4f-4f躍遷幾率低,導(dǎo)致其摩爾吸光系數(shù)小,熒光效率不高,同時(shí)配合物中若存在配位小分子,其振動(dòng)猝滅效應(yīng)亦會(huì)進(jìn)一步降低稀土離子的熒光效率,這些原因阻礙了其應(yīng)用。因此,有機(jī)配體的選擇和配合物結(jié)構(gòu)的設(shè)計(jì)對(duì)于開發(fā)**稀土有機(jī)配合物發(fā)光材料尤為重要。
有機(jī)配體的選擇
在稀土有機(jī)配合物的合成過程中,由于配位鍵和范德華力鍵能相對(duì)較低,使配位反應(yīng)更加敏感,常常受到稀土種類、有機(jī)配體種類、稀土配體的摩爾比、pH值、溫度和時(shí)間等因素的影響。值得注意的是,選擇合適的配體在構(gòu)筑稀土有機(jī)配合物的新穎結(jié)構(gòu)方面起到非常重要的作用。
羧酸類配體中具有負(fù)電性的羧基可以與正電性的金屬離子進(jìn)行電荷補(bǔ)償,鍵合形成具有電中性金屬有機(jī)配合物骨架。除此之外,羧基中的氧原子易形成氫鍵,也能使配合物結(jié)構(gòu)的穩(wěn)定性增強(qiáng)。鑒于此,芳香族羧酸是良好的候選有機(jī)配體,因?yàn)樗哂杏H氧性,因而具有高親和稀土金屬離子傾向。此外,根據(jù)取代基的不同及其在苯環(huán)上占據(jù)取代位點(diǎn)的不同,可以獲得多種結(jié)構(gòu)或維度的配合物。
苯甲酸基稀土有機(jī)配合物
苯甲酸作為一種剛性芳香族羧酸類配體,結(jié)構(gòu)上具有一定的穩(wěn)定性,是構(gòu)筑金屬有機(jī)配合物的常用配體。由于苯甲酸中含有一個(gè)羧酸基團(tuán),且羧基的配位平面可以發(fā)生旋轉(zhuǎn),因此取向更加靈活,可以采用單齒、雙齒、橋連及螯合配位,形成多樣的金屬有機(jī)配合物骨架結(jié)構(gòu)。
在水熱的條件下合成一個(gè)鉺配合物[Er2(BA)6(DMF)2( H2O)2](DMF=N,N-二甲基甲酰胺,BA=苯甲酸)。Er3+離子連接BA配體和DMF形成一維鏈,進(jìn)而通過氫鍵作用,相鄰的一維鏈形成二維網(wǎng)狀結(jié)構(gòu)(圖2)。對(duì)此配合物的光致發(fā)光性質(zhì)研究表明,配體的間接激發(fā)比Er3+的特征躍遷要強(qiáng)烈得多,說(shuō)明苯甲酸配體對(duì)Er3+具有**的敏化作用。
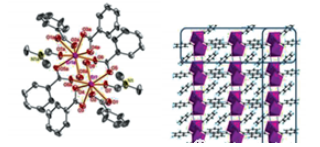
圖2 [Er2(BA)6(DMF)2(H2O)2]的結(jié)構(gòu)
wyf 03.18




 齊岳微信公眾號(hào)
齊岳微信公眾號(hào) 官方微信
官方微信 庫(kù)存查詢
庫(kù)存查詢