**的光動(dòng)力**是利用基于各種過(guò)渡金屬制備的光敏劑在光照下,耗竭線粒體中NADH從而破壞線粒體氧化還原電子傳遞鏈,進(jìn)而引起氧化應(yīng)激和細(xì)胞凋亡。然而在光動(dòng)力**中,缺氧性**是令醫(yī)生們**頭疼的一種**,因?yàn)橐话愕墓饷魟┑碾娮愚D(zhuǎn)移都需要氧氣的參與,使得這些光敏劑對(duì)缺氧性**細(xì)胞(hypoxic cancer cells)失去效果。除此之外,細(xì)胞內(nèi)抗氧化系統(tǒng)解毒、誘導(dǎo)應(yīng)激反應(yīng)基因和P-糖蛋白介導(dǎo)**外排都會(huì)使**細(xì)胞產(chǎn)生抗藥性,使得新型光敏劑的開(kāi)發(fā)變得尤為重要。
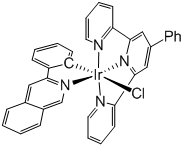
開(kāi)發(fā)了一種新型的銥(III)光敏劑,在正常含氧和缺氧性**細(xì)胞中均具有良好的活性。化合物1結(jié)構(gòu)如圖所示,由一個(gè)C,N雙齒配體(pq)和一個(gè)N,N,N三齒配體(ttpy)組成,Cl與C成反式,在特定波長(zhǎng)光激發(fā)下,電子由pq配體激發(fā)到ttpy的π反鍵軌道**形成三重態(tài)激發(fā)態(tài)。驗(yàn)證了化合物1在有機(jī)溶劑、磷酸緩沖液以及血清中均具有良好的光/暗穩(wěn)定性,隨后通過(guò)循環(huán)電勢(shì)法測(cè)得激發(fā)態(tài)的1具有高達(dá)1.22V的氧化電勢(shì)(參比電極為甘汞電極),通過(guò)密度泛函分析驗(yàn)證了1與基態(tài)相比氧化還原的電子行為差異很大,說(shuō)明1是一種強(qiáng)的激發(fā)態(tài)氧化劑。
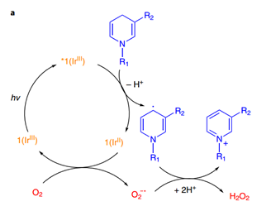
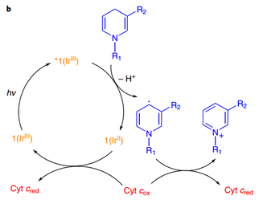
在體外正常含氧量條件下測(cè)試了1對(duì)NADH的氧化,光照條件下,1在重水/氘代甲醇體系以及磷酸緩沖液體系中,均能快速消耗NADH(30 min,95% NADH consumed)并生成過(guò)氧化氫(由過(guò)氧化物試紙監(jiān)測(cè)),隨后在體系中加入自由基捕獲劑CYPMPO可以檢測(cè)到CYPMPO-NAD,證明了1對(duì)NADH的氧化經(jīng)歷了單電子轉(zhuǎn)移,通過(guò)密度泛函分析,他們計(jì)算出電子轉(zhuǎn)移是通過(guò)NADH與1*中的pq或ttpy配體的π-π相互作用實(shí)現(xiàn)的。若在氮?dú)夥諊拢捎跊](méi)有終端電子受體,光反應(yīng)不能發(fā)生。線粒體中的細(xì)胞色素C(cyt c)可以作為電子受體[cyt c (Fe2+/Fe3+)],在不含氧且加入cyt c的條件下,1可以在光照下順利氧化NADH。
在完成細(xì)胞外實(shí)驗(yàn)之后,又測(cè)試了化合物1對(duì)一系列**細(xì)胞和幾種正常細(xì)胞(MRC-5, LO2)的殺傷效果。在無(wú)光條件下,無(wú)論是含氧還是缺氧,1對(duì)所有細(xì)胞均只有低毒性,而在光照條件下,無(wú)論含氧還是缺氧,1的細(xì)胞毒性均大大增加,具有較高的光細(xì)胞毒指數(shù)(dark IC50/lightIC50),在缺氧條件下,臨床前藥5-ALA無(wú)效的幾種**細(xì)胞[NCI-H460 (lung),HeLa (cervix), Hep G2 (liver), SGC-7901 (gastric)],均受到1的**,而且這種**效果不受ROS捕獲劑的影響。在A549實(shí)體瘤模型中,1也表現(xiàn)出良好的光細(xì)胞毒指(dark/light:12.6/1.3μM),而同樣的缺氧條件下,5-ALA和順鉑幾乎沒(méi)有光毒性。
來(lái)源:本文來(lái)源網(wǎng)絡(luò),版權(quán)歸相關(guān)權(quán)利人所有,如侵權(quán),請(qǐng)聯(lián)系刪除
wyf 12.04




 齊岳微信公眾號(hào)
齊岳微信公眾號(hào) 官方微信
官方微信 庫(kù)存查詢
庫(kù)存查詢