1. 背景
在過去的十年中,金屬有機框架(MOFs)已被報道用于多種應用,包括氣體分離/吸附、光電子、傳感、能源相關應用、催化、膜技術和藥物輸送。在藥物輸送領域,一些用于腫瘤藥物輸送的材料正在進行臨床試驗。這種網狀化學的發展導致了一種新的晶體多孔材料家族的產生,稱為共價有機框架(COFs),它完全由有機支架組成,不含金屬離子。這一領域出現于2005年,近年來蓬勃發展。
COFs由碳、氫、氮、氧、和硼或硫等非金屬元素組成,這些元素通過強共價鍵連接在一起,形成2D/3D晶體周期結構。由于有機合成的廣泛多樣性,COFs可以產生具有各種結構的有前途的材料,實現結構到功能的應用。與mof類似,COFs也被廣泛應用于氣體物質的分離、化學和生物識別、多相催化、光電子、能量存儲和轉換、傳感、光熱和光動力治療等領域。
COFs 在醫學中的應用 :在聚合物體系中,COFs是生物醫學應用的新興候選人,因為:(a) 它們的模塊化和可調結構,可用于熒光成像或與目標結構結合,(b)固有孔隙,可用于上傳客體分子,如藥物分子;(c) COFs的結構幾何參數和拓撲結構可以調整,使COFs具有多種光學特性的有趣材料,這些特性無法與其單體分開使用,**終可以為成像和治療方面提供額外的特性。(d)與MOFs相比,COFs本質上不含金屬,因此沒有金屬離子浸出引起的潛在生物毒性方面的擔憂。
COFs可以擁有2D或3D架構。大多數報道的結構本質上是二維的,由共價鍵連接在一起的二維納米片組成這些納米片通過非共價π π相互作用堆疊。COFs的拓撲結構和幾何形狀可以根據其單體(包括官能團)的分子幾何形狀來預先定義。,COFs可以通過控制其單體的空間維度來進行2D/3D空間位置的控制,這是COFs優于非晶聚合物的優點. **COFs的常見方法和時間歷程如圖1所示
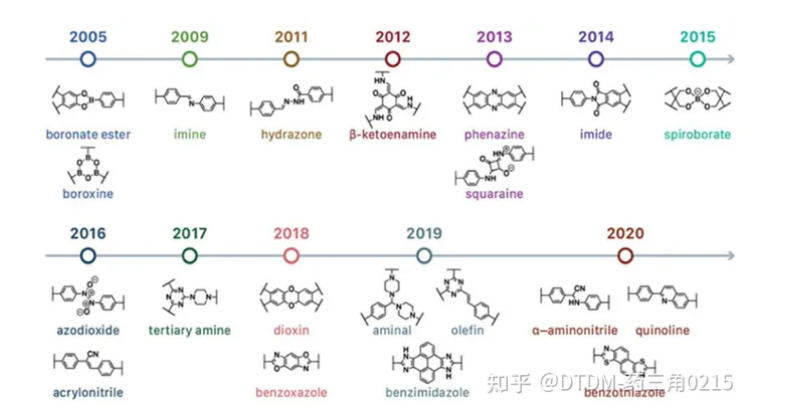
圖1. COFs 合成和發展時間軸
COFs的合成有以下幾種方法:(a)離子熱法,(b)機械化學法,(c)微波法,(d)溶劑熱法,(e)常壓液相合成,(f)聲化學法。
離子熱合成是指在離子液體中合成COFs,離子液體是室溫下的液體,是一類有機鹽類。離子液體作為傳統揮發性有機溶劑的替代品,具有環境友好性,具有廣闊的工業應用前景。
擠壓、剪切和摩擦等機械力/能量可以作用于物質,通過形成新的化學鍵導致分子發生化學變化,這被稱為機械化學。隨著機械技術的發展和越來越多地使用研磨和球磨儀器,這些通用的過程已被用于通過機械化學途徑合成不同的化合物。在機械化學合成COFs的情況下,應用不同的機械工藝,如成型和使用砂漿、擠出機、球磨機和/或3D打印機。事實上,機械化學合成幾乎不需要溶劑,使其成為一種更環保的合成途徑。另一種方法是微波合成,采用微波輻射/加熱,在短時間內加熱穩定,不需要任何熱傳導。的確,與傳統的加熱方法相比,微波反應速度更快,效率更高,從而節省了時間。
溶劑熱法是合成COFs**常用的途徑。**,大多數COFs都是使用這種途徑合成的,在這種途徑中,反應在一定溫度下在密封容器內進行,通常溫度是升高的。這通過溶劑的自壓力在密封容器中產生增強的壓力,**終得到再結晶的材料。通常,一個內襯聚四氟乙烯(PTFE)的容器被放置在一個不銹鋼容器內,連同一個厚壁的耐熱玻璃管,也可以用來維持升高的溫度。合成后,將粗粉用有機溶劑洗滌幾次,然后在真空下干燥。尺寸較大/較大的聚四氟乙烯襯墊也可用于大量材料的合成。
常壓液相合成是在常壓和室溫下進行的,這是Zamora等人首次報道的,其中1,3,5-三(4-氨基苯基)苯和苯-1,3,5-三乙醛在DMSO中攪拌48小時,得到粉狀產品。這為大規模生產開辟了新的方向。
聲化學方法是制備COFs的另一種方法,包括使用聲波來合成它們。根據合成所使用的功率,結構可以變化。在少溶前體的情況下,這種方法是有用的。Ahn等人報道了通過改變1,4-苯二硼酸和2,3,6,7,10,11-六羥基三苯之間的聲納功率來合成多功能COFs的聲化學方法。
對于特定靶標的生物醫學應用,COFs支架需要多種功能位點。有利的是,COFs可以通過功能化進行修飾,可以采用以下兩種方法:(i)合成前修飾:在前體合成之前進行修飾,即pre-SM;(ii)合成后修飾:在COF支架合成之后進行修飾,即post-sm。在pre-sm的情況下,在單體中引入官能團,可用于制備功能化的cof。然而,由于合成途徑的限制,并不是所有類型的COFs都可以用這種方法制備,從而限制了其利用。在post-sm的情況下,COFs可以通過保持面向目標的錨定基團不受合成后修飾的影響來合成。合成后,可根據目標對同一基團進行修飾。在某些情況下,如果修飾的目標分子比孔大,那么只能進行表面修飾/功能化。這一過程的示意圖如圖2所示
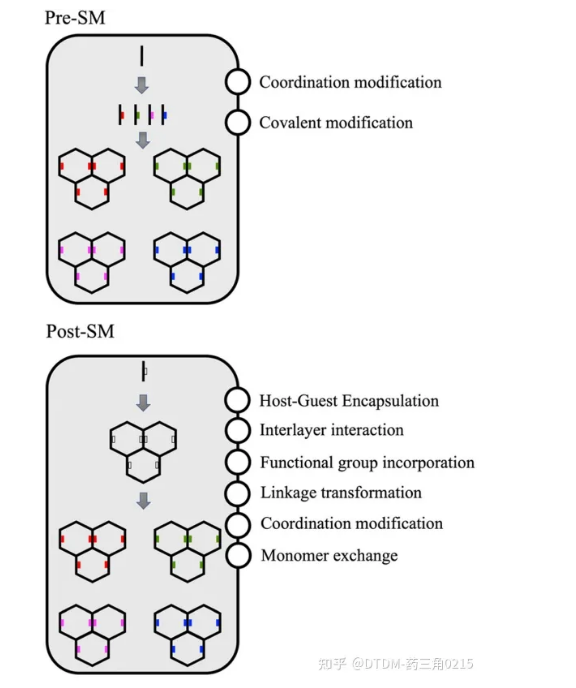
圖2 . COFs的多種功能化:Pre-SM 和 Post-SM
COFs易于合成和多功能化使其具有廣泛的應用。COFs的新興應用之一是在生物醫學領域,其中**好的想法之一是藥物封裝/解封裝。一些藥物分子存在生物穩定性低、腫瘤靶向性差等問題,利用靶向性COFs作為遞送貨物可以克服這些問題。COFs在生物醫學領域的另一個應用是光動力治療(PDT),這是一種微創治療方法,在COFs中加載多功能光敏劑。隨后,它們吸收光,通過氧的激發形成活性氧,**終導致癌細胞死亡。另外,光熱療法(PTT)是COFs的另一個重要應用,其中COFs中的光熱劑吸收近紅外范圍內的輻射。光熱劑的激發態能量通過非輻射松弛以熱的形式散失,**終使細胞溫度升高而破壞細胞。因此,本文就該領域的研究進展作一綜述。
脂質體、二氧化硅、mof和多孔碳基納米顆粒已被報道為藥物載體。脂質體是可溶性和/或可生物降解載體的一個例子,它們在應用后分解,其中它們的親水頭部對準超分子結構的內部和外部以及由它們的疏水尾部組成的膜的內部。脂質體的直徑一般為100-200nm。使用生物相容性聚合物如聚乙二醇可以提高循環時間,導致更大的生物利用度。二氧化硅具有高表面積體積比,這使得表面改性,同時保持高孔隙率。**,多種藥物的體外和體內遞送都已實現。mof是一種高度有序的結構,具有永久孔隙和大表面積。它們是由配體與金屬離子/簇通過配位鍵組裝而成的。它們有一個具有化學性質的可調支架,這種高度有序的結構,使它們的化學性質能夠控制。因此,mof已成為腫瘤藥物輸送和應用的合適候選者,目前正在進行臨床試驗。通常通過熱解合成的多孔碳基納米顆粒也可用于藥物遞送,因為它們具有高表面積和物理化學性質。介孔碳納米材料將近紅外光轉化為熱的能力促進了其在聯合光熱治療和化療中的應用。
盡管使用不同的藥物載體取得了很大的進展,但它們仍然表現出一些缺點,如下:(a)從載體中浸出有毒物質,例如金屬離子,(b)合成繁瑣,(c)缺乏化學穩定性,(d)功能途徑復雜,(e)藥物釋放不受控制。因此,只有少數被用于臨床試驗。在這方面,基于cof的遞送系統可以應用于納米醫學的許多領域,因為它可以克服以下幾個挑戰:(a)易于調節的形態,導致高表面積和孔隙度;(b)由于缺乏金屬而具有良好的穩定性,導致低密度結構;(c)在生物樣品/介質中具有更好的分散性;(iv)易于細胞攝取和(v)可控釋放。
COFs的高可調表面積和明確的多孔結構使其可用于藥物遞送。此外,它們的有機構建塊的易于功能化將有助于在形狀-尺寸-表面性質方面定制孔隙,從而增加Π–Π, CH–Π,H鍵與客體藥物分子相互作用的范德華力的機會,這將有助于提高Drug-COF加合物的穩定性。此外,具有輕質元素的COFs的有機骨架使其比mof更適合用于藥物遞送。在預期遞送之前藥物浸出是許多藥物載體的另一個問題,因為在表面吸附的情況下很難防止浸出;然而,它可以通過孔隙通道封裝使其**小化。總之,COFs可能優于當代藥物載體。
2. COFs 對阿霉素遞送給藥
自20世紀60年代以來,從peucetius鏈霉菌中提取的阿霉素(DOX)已被用作*生素和化療藥物。在結構上,它是蒽環類化療藥物的一部分。DOX可用于治療實體瘤、軟組織癌、甲狀腺癌、膀胱癌、卵巢癌、乳腺癌、肺癌、不同類型的白血病以及骨肉瘤。在鉑類化療失敗的患者中,經FDA批準,DOX可以插入DNA堿基對,從而導致DNA鏈斷裂。DOX可通過抑制拓撲異構酶II引起DNA損傷導致細胞凋亡。每隔21天靜脈注射一次。為了減少輸液反應的機會,可以進行脂質體制劑的緩慢給藥。它在組織中分布迅速,消除半衰期為48小時。DOX在鹽水中的穩定性相對較低,溶液必須避光。因此,考慮到這一點,DOX的控制遞送是非常重要和必要的。
2.1
Xi, Huang and Jia報道的COF框架是通過姜黃素衍生物的自組裝得到的,然后用聚乙二醇(PEG-CCM)對其進行重組,COF-1被胺(APTES-COF-1)功能化,稱為polymer-COF 納米復合物(PEG-CCM@APTES-COF-1)。它形成了膠束結構,其中有機相是用APTES-COF-1形成的,表面活性劑是用PEG-CCM制成的。采用不同尺寸的PEG-CCM加合物PEG350-CCM、PEG1000-CCM和PEG2000-CCM制備一系列COFs,分別為PEG350-CCM@APTES-COF-1、PEG1000-CCM@APTES-COF-1和PEG2000-CCM@APTESCOF-1。PEG修飾的APTES-COF-1有利于其在水中的分散,DLS分析顯示PEG350- CCM的粒徑為20 (±5)nm, PEG1000-CCM的粒徑為30 (±7)nm, PEG2000-CCM的粒徑為45 (±10)nm。其中PEG2000-CCM@APTES-COF-1的熒光強度**高。
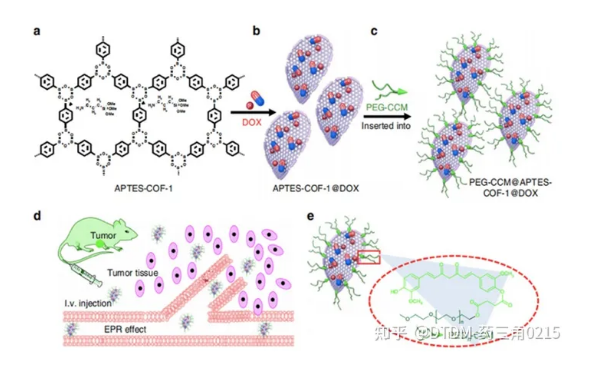
圖3. PEG-CCM@APTES-COF-1的DOX負載合成及靶向給藥小鼠效果
事實上,熒光測量證實,負載dox的COFs主要積聚在小鼠的肺和肝臟,皮下注射導致其積聚在腫瘤組織中。在小鼠的腎、腦、脾和心臟中觀察到輕微/輕微的積累。有趣的是,注射24小時后,腫瘤組織中PEG2000-CCM@APTES-COF-1和dox負載PEG2000-CCM@APTES-COF-1的含量高于其他器官。在COFs中,負載dox的PEG2000-CCM@APTES-COF-1在腫瘤細胞中表現出更高的遞送能力。24 h后,負載DOX的PEG2000-CCM@APTES-COF-1在腫瘤組織中的熒光信號分別比PEG350- CCM@APTES-COF-1、PEG1000-CCM@APTES-COF-1、PEG2000-CCM@APTES-COF-1和游離DOX高1.7倍、1.8倍、1.6倍和8.3倍。事實上,載藥的COFs被細胞內化,暴露于細胞的酸性隔室時可以釋放藥物。在載藥COFs和游離DOX中,PEG2000-CCM@APTES-COF1@DOX表現出**好的腫瘤抑制效果(圖3)。
2.2
Pang和Lin等人報道了通過1,3,5-三(4-氨基苯基)苯(TAPB)和2,5-二甲氧基對苯二醛(DMTP)在室溫下縮合反應合成一種用于遞送DOX的COF,命名為TAPB-DMTP-COF。在合成COF的過程中,藥物被加載,DMTP和DOX攪拌1小時,然后為了完成反應并得到所需的產物,加入TAPB形成所需的DOX@COF。ttap - dmtp -COF的表面積為1000 m2 g1,孔徑為3.298 nm,在COF中原位加載DOX后減小。通過UV-Vis分析,DOX@- COF中DOX的負荷量約為32.1%。在卸藥過程中,40%的DOX在pH 7.4條件下在前2小時內釋放,而在pH 5或6.5條件下,大部分藥物在前2小時內釋放。觀察到,在pH 7.4時,DOX@COF的形態在2h內由球形變為不規則塊狀。這表明希夫堿基團在PBS中被降解。通過降低pH值或增加反應時間,DOX@COF被完全破壞,**終藥物被釋放。但仍有必要進一步了解COFs在它們降解成小份后,是否有毒。
2.3
也有報道磺化微孔有機網絡的三殼空心球(TH-SMON)和雙殼SMON空心球(DH-SMON)的制備,用于高效遞送DOX。報道指出單殼中空SMON (H-SMON)的合成是通過1,4-二碘苯和四(4-乙基苯基)甲烷在硅球表面的Sonogashira偶聯形成MON(微孔有機網絡),然后蝕刻,然后表面磺化。另一種合成方法,首先引入咪唑酸分子篩框架(ZIF-8),然后采用與H-SMON相似的方法,對ZIF-8進行蝕刻和磺化,得到DH-SMON作為一種水相容性材料。重復該過程以提供TH-SMON。采用SEM/TEM對COFs進行形貌分析。H/DH/TH-SMON的平均直徑分別為B220 nm、B300 nm和B380 nm。經DOX處理后,H/DH/TH-SMON的負載效率分別為83%、89%和95%(1%)。在pH為7.4的PBS培養基中,在37℃下完成DOX的卸載。7天后,觀察到COFs的DOX釋放量(即H/DH/TH-SMON)分別為載藥量的62%、80%和92%。用MCF-7細胞檢測了DOX的遞送性能,其中DOX/TH-SMON顯示,在100 mg mL1負載下,DOX的遞送增加,癌細胞存活率僅為38%(圖4)。因此,外殼數量的增加提高了癌細胞的藥物包封/解封效率。
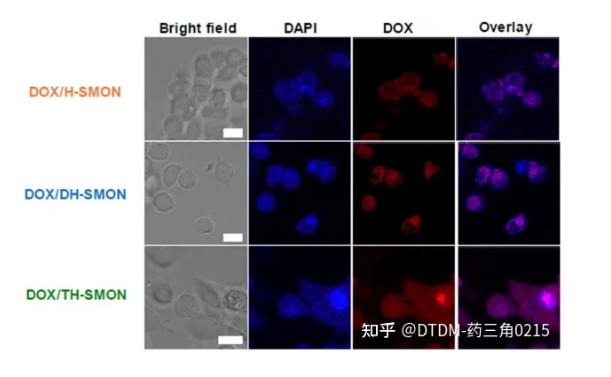
圖4. 負載DOX的HSMON、DH-SMON和THS-MON處理MCF7細胞系1小時的共聚焦圖像
2.4
Zhang和他的同事們研究了聚乙二醇化氧化還原反應的納米級COFs,以有效地在細胞中加載/卸載DOX。通過苯1,3,5-三乙醛和4,4’ -二硫代二苯胺之間的席夫堿形成COFs,然后將含二硫的COFs (SS-COF)和Pluronic F68自組裝生成F68@SS-COF納米載體。SS-COFs的表面積為672 m2 g1,孔徑分布較窄,為B2.3 nm。通過在pH為5的PBS中引入10 mM GSH,氧化還原反應性COF完成了DOX的卸載,而非反應性COF (F68@nCOFs)沒有表現出令人滿意的藥物卸載。同樣的趨勢在HepG2細胞中觀察到反應性和非反應性載藥COFs的遞送。然而,載藥F68@SS-COFs的IC50值為B3.62 mg mL1,與游離DOX相比(IC50-DOX = 1.78 mg mL1)升高。通常,二硫鍵會在低pH介質中打開/還原,因此了解COFs在酸性介質中的結構,即在pH為5的PBS中加入10mm GSH,仍有待探索。
2.5
Liu等研究了pH響應共價有機聚合物(cop)。以4,4’-三亞甲基雙哌替啶和丙烯酰中四(羥基苯基)卟啉為原料合成了天然可生物降解的b-氨基酯(THPP-BAE-PEG)。采用聚乙二醇(PEG)制備聚乙二醇(PEG)殼,對反應進行淬滅,得到殼狀支架。發現該材料具有球形形貌,其平均直徑為30 - 40 nm。pH 6.0時,PBS培養基中DOX的脫囊率高于pH 7.4,表明BAEs支架在低pH培養基中降解。隨后,在4T1荷瘤Balb/c小鼠中研究了COF-DOX作為化療-光動力藥物的聯合應用,該藥物使腫瘤生長減少。
2.6
Gong和Liu等報道了高熒光COFs,顯示了視覺藥物加載和ph反應卸載。該體系是由π-π共軛的三(4-甲基苯基)胺單體與聯苯胺反應生成的。用不同的光譜技術對化合物進行了研究,以確保COFs和COFs的形成,SEM數據表明,這些多孔COFs的平均尺寸約為200 nm。制備的COFs具有亮藍色發光。DOX被裝入COF與DOX之間的π-π相互作用和豐富的氧基容易形成氫鍵相互作用促進了COFs的形成。此外,DOX-COF耦合產生FRET,其中COF可以淬滅DOX的排放。**大載藥量為B35%。在酸性條件下(pH b5)獲得有效藥物釋放,據報道,72小時后,與中性條件相比,COF + DOX在A549細胞中的細胞攝取測定顯示,共聚焦顯微鏡和流式細胞術顯示,藥物(在癌細胞環境下釋放)在細胞質和細胞核中的清晰分布。單獨的COF對癌細胞的毒性較低(根據MTT試驗),而0.375 mg mL1的COF + DOX殺死了幾乎80%的癌細胞。此外,發現COF + DOX具有有效的*腫瘤細胞遷移特性。
2.7
Tang等人研究了一類新的COF系統(TpDh),稱為核酸門控COF納米系統,用于癌細胞特異性成像/藥物卸載。在這種情況下,卟啉COF納米顆粒(NPs)裝載了DOX貨物。在dox負載的COF表面,cy5標記的單鏈DNA(ssDNA)被吸附。利用Cy5和DOX卸載的熒光來檢測腫瘤細胞中釋放的ssDNA。在完整的情況下,Cy5熒光通過FRET被COF-DOX加合物猝滅,在特異性TK1 mRNA靶釋放后可檢測到。COF納米顆粒對藥物(DOX)的載藥量為0.330 mg ml / 1,對ssDNA的載藥量為0.97 nmol mg / 1。體外藥物卸載分析表明,在生理pH下,加合物的藥物卸載量不到2% (drug@COF)。在MCF-10A(正常細胞)和MCF-7(癌細胞)細胞上觀察藥物填充后COF的顯像和藥物卸載情況。MCF-7細胞中DOX和Cy5均可見高熒光信號,但MCF-10A細胞中未檢測到信號,與相應的共聚焦圖像一致。流式細胞術分析也證實了這一結論。COF的合成示意圖如圖5所示
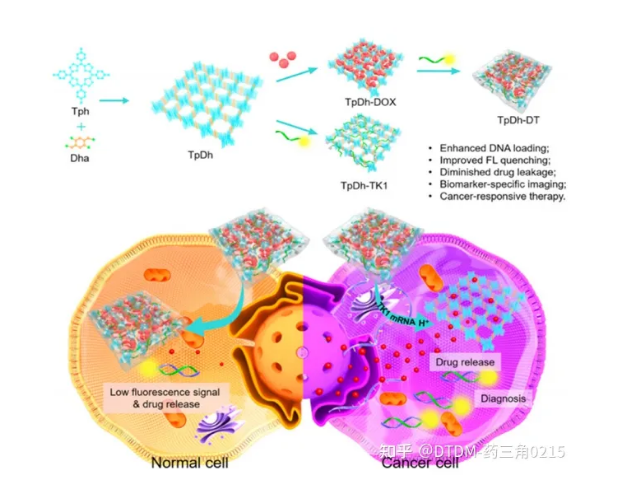
圖.5 TpDh合成的示意圖,癌細胞的成像和治療效果
2.8
Wang等人報道了通過5,15-雙(4-硼苯基)-卟啉和2,3,6,7,10,11-六羥基三苯共縮合反應制備二維COFs (TP-Por)。為了解決COF的水不穩定性,使用了菁氨酸IR783,這也是一種潛在的治療藥物。在不同質量比的水溶液超聲剝離條件下,將COFs與商用IR783混合合成納米復合材料(COF@IR783),其平均直徑為~ 320 nm。通過TEM、SEM、FT-IR和固態核磁共振分析了預期COFs的形成。非局部密度泛函理論(NL-DFT)計算表明COF@IR783的孔徑分布為~ 0.65 nm。此外,將前藥順式烏頭酰阿霉素(CAD)成功加載到納米復合材料中,在PBS緩沖液中生成COF@IR783@CAD, 24 h后發現前藥在PBS中的卸載率為~ 48.2%。通過流式細胞術和4T1細胞共聚焦顯微鏡檢測COF@IR783@CAD的細胞攝取。眾所周知,細胞表面帶負電荷;因此,帶正電荷的實體可能更容易穿透細胞,然而,作者認為納米復合材料上的負電荷有利于有效的細胞滲透性。在碘化丙啶染色研究中發現,IR783聯合*腫瘤藥物遞送(通過808 nm激光照射5分鐘)在細胞活力方面**有效。激光聯合治療COF@IR783@CAD顯示出對小鼠腫瘤生長的抑制作用。
2.9
Anbazhagan等人報道了利用2,5-二(甲基磺酰基)-1,4-二疊氮苯(BMS-DAB-N3)和1,3,5-三乙基苯(TEB)之間的點擊化學反應,制備了一種新型的硫醚端三唑橋的共價有機骨架(TCOF)。采用多種光譜技術對TCOF進行了表征,發現其孔徑為10 ~ 30nm。聚乙二醇化是在合成后進行的,然后用作*癌藥物傳遞系統。TCOF的表面積為58.871 m2 g-1。TCOF-DOX-PEG,即負載dox的TCOF-PEG,是由靜電(π π)和氫鍵相互作用形成的。藥物釋放研究在pH為7.4的PBS培養基中進行,其釋放率僅為20%,而在pH為5(溶酶體癌環境)和GSH環境下,72 h內載藥物的脫囊率接近70 - 80%。TCOF-DOX-PEG與15 mg mL-1載藥COF孵育時,殺傷HeLa細胞的能力僅為56%,這表明了DOX在HeLa細胞中的緩慢釋放和TCOF-DOX-PEG的內化作用。
2.10
Zhou等人報道了合成以二硒和亞胺為基礎的COFs來遞送DOX。5,10,15,20-(四-4-氨基苯基)-卟啉(Por)與4,40 -二乙烯二苯甲醛(dis)通過席夫堿反應共聚制得COF-DiSe -Por,并用TGA、TEM、FT-IR和XRD等分析技術對其進行了表征。結果表明,BET表面積為73.5 m2 g-1,當DOX添加量為35.12%,質量比為1:2(料藥比)時,BET表面積減小至7.9 m2 g-1。孵育96 h后,pH值為7.4時,DOX釋放量為27.9%,pH值為6.5時釋放量為42.4%,pH值為5.5時釋放量為61.3%。在細胞內化后,細胞內的酸性pH和GSH使C=N和Se-Se鍵斷裂,**終幫助藥物釋放。Se - Se鍵的斷裂誘導ROS的產生,打破細胞氧化還原平衡,加速細胞死亡。808 nm近紅外激光照射6 min作為藥物釋放的刺激。在GSH、pH和光的共同作用下,DOX的釋放量達到89.6%。在這種情況下,降解的COF支架的副作用,特別是細胞對硒基支架的反應還有待深入的研究。
3. COFs對5-氟尿嘧啶(5-FU)的遞送給藥
5-FU是一種*代謝藥物,用于結腸直腸癌、上呼吸消化道鱗狀細胞癌和乳腺癌的多種醫學治療。一般來說,*代謝化合物通過抑制基本的生物合成過程或將自身結合到生物大分子(如RNA和DNA)中來起作用,從而阻礙正常的細胞功能。5-FU在這兩方面都具有很強的*癌能力。細胞滲透/內化過程與尿嘧啶一樣迅速,然后5-FU在細胞內環境中轉化為幾種活性代謝物。5-FU能抑制核苷酸合成酶胸苷酸合成酶(TS)。然而,5-FU藥物在二氫嘧啶脫氫酶(DPD)作用下失去活性,DPD將5-FU轉化為二氫氟尿嘧啶(DHFU)。DPD抑制劑,如烯尿嘧啶和5-氯二氫嘧啶(CDHP),被檢查調節該藥物的活性。總的來說,5-FU的輸送對治療癌癥有顯著的影響。
3.1
Zhao等人報道了通過改變胺的數量,通過醛和胺的縮合合成COFs,即PI-3-COF和PI-2-COF,其中3表示三胺,2表示COF結構中的兩胺。PI-3-COF的BET表面積為1000 m2 g-1, PI-2-COF的BET表面積為1700 m2 g-1。由于5-FU作為*癌藥物的效用,它被用作遞送的靶向藥物。考察裸COFs、5-FU和藥物包封COFs (5-FU@PI-2/3-COF)的細胞活力。以200 mg mL-1的濃度與COFs孵育24 h后,裸COFs的存活率達到80%以上。與5-FU@PI-3-COF相比,5-FU@PI-2-COF培養的MCF-7細胞活力較低,說明PI-2-COF具有更強的藥物包封能力。用共聚焦顯微鏡觀察5- fuencapsulation COFs是否可以通過內吞途徑內化。通過共聚焦顯微鏡分析,未處理的細胞沒有熒光,而5-FU@PI-2-COF/ pi -3- cof處理的細胞的藍色發射表明5- fucof加合物進入了細胞(圖6)。
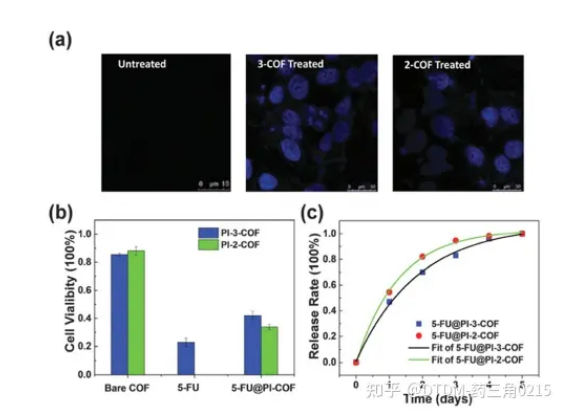
圖.6 (a)加載或未加載5fu的COF處理的細胞共聚焦圖像,(b)細胞活力分析,(c)從包封的COF中卸載5-FU
Hashemzadeh等人使用同樣的PI-3-COF對5-FU的吸附進行了量子力學和分子動力學研究。在初步階段,采用離散傅里葉變換對5-FU的幾何參數進行了研究。量子力學分析表明,藥物吸附加合物是穩定的,過程是放熱的。π鍵和氫鍵相互作用穩定了5FU-COF加合物。從自然鍵軌道分析可以看出,電荷從COF轉移到5-FU,從分子動力學可以看出,5-FU擴散到COF孔是一個緩慢的過程。
3.2
Banerjee等人報道了通過希夫堿縮合法制備TpAPH和TpASH共價有機納米片作為二維多孔有機高分子材料。隨后,對TpASH進行了三次合成后修飾,制備了TpASH-FA(葉酸偶聯TpASH)。該化合物用于靶向遞送5-FU至MDA-MB-231細胞(乳腺癌細胞的代表)。采用TpASH、TpASH-FA- 5FU(靶向載藥探針)和TpASH-APTES- 5FU(非靶向載藥探針)在pH 7.4 遞送5FU。pH為5.0時,72 h內釋藥率為74%。采用MTT法測定TpASH的生物相容性,顯示其具有生物相容性。生物學分析顯示,靶向載藥探針(TpASH-FA- 5FU)比非靶向載藥探針TpASH-APTES-5FU具有更大的殺死癌細胞的潛力。合成、合成后修飾和給藥的示意圖如圖7所示。
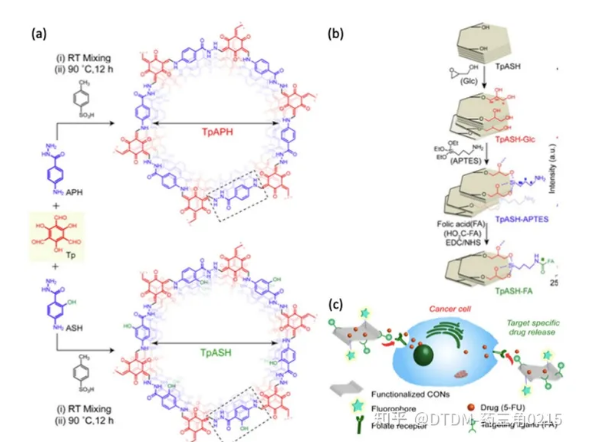
圖.7 (a)TpAPH和TpASH的合成方案,(b)修飾-合成后 (c)給藥到癌細胞。
3.3
Li和Wang報道了8-羥基喹啉功能化希夫堿COFs的合成,用于5-FU的遞送。COF的BET比表面積為80.4781 m2 g-1,孔徑為3.7 nm。利用透射電鏡(TEM)和傅里葉紅外光譜(FT-IR)分析了COF-HQ在水、DMEM/10% FBS和PBS中的穩定性。在pH 7.4和pH 5.0 37℃條件下進行5-FU的卸載,并通過紫外可見光譜進行監測。在pH 5.0時,藥物釋放量比pH 7.4時高約14%。
4. COFs對布洛芬的遞送給藥
布洛芬(IBU)是一種廣泛使用的非甾體*炎藥(NSAID),用于治療炎癥、風濕病和疼痛。攝入后吸收迅速,蛋白結合度高。IBU是一種弱酸,脂溶性,分子量為5 ? 10 ?;因此,它可以穿過細胞膜而不需要特定的轉運體。IBU的主要作用機制是抑制COX-1和COX-2環氧化酶,進而直接抑制類前列腺素的合成,這與體內平衡和病理過程有關。它還通過清除炎癥過程中產生的活性氧和活性氮(HO·、·NO和ONO-)發揮*炎作用。然而,與其他非甾體*炎藥類似,在高劑量時,它可能導致胃腸道和心血管問題。IBU的生物半衰期為2小時,因此它是持續或控制藥物遞送的潛在候選者。
4.1
Li等報道了設計合成具有菱形平鋪(kgd)拓撲結構的多用途微孔二維COFs。以六(4-甲苯基)苯(HFPB)為頂點,以三種不同的三(4-氨基苯基)胺(TAPA)、1,3,5-三[4-氨基(1,1-聯苯-4-基)]苯(TABPB)和三(4-氨基苯基)三嗪(TAPT)為邊實現了目標拓撲結構。HFPB-TAPA微孔尺寸為B6.7 ?,成功應用于藥物載體。HFPB-TAPA的BET表面積為852 m2 g-1,可以在己烷中裝載14 wt%的IUB。將ibu負載的COFs浸泡在pH = 7.4, 310 K的PBS中,HFPB-TAPA在5天后卸載99%。此外,HFPB-TAPA在處理大鼠源性H9C2心肌細胞期間觀察到低細胞毒性。
4.2
Negishi等人報道了一種合理的設計,通過將棱柱節點(四邊形)與方形平面節點連接,生成具有有趣拓撲結構的3D COF (TUS-84)。TUS-84是由C4對稱連接劑、D2h對稱連接劑、4',5'-雙(3,5-二甲基苯基)- 3',6' -二甲基-[1,1',2',1'' -三苯基]-3,3'',5,5''-四乙醛和5,10,15,20-四(4-氨基苯基)-卟啉[8+4]亞胺縮合反應制備的。其比表面積為679 m2 g-1,為雙重互穿多孔結構。在正己烷溶液中成功加載了IBU,加載后其BET表面積減小到462.7 m2 g-1。在pH為7.4的模擬體液中,加藥后 5 天的TUS-84釋藥性能為35%,有利于延長給藥時間,降低給藥頻率。他們還報道了卡托普利的裝載情況,在相同的條件下,5天內卡托普利的釋放率達到98%。
4.3
Chen等人報道了用HAPTP[2,3,6,7,10,11-六(4-氨基苯基)三苯]與幾種醛連接,在溶劑熱條件下用自模板法制備了不同的COFs,并通過多種顯微和光譜技術證實了這一點(如圖8所示)。HAPTP-TPA 2DCOFs、HAPTP-TFPB和HAPTP-TFPA 2DCOFs的BET表面積分別為B954.9 m2 g-1、B531 m2 g-1和B829 m2 g-1。將COF浸潤在IBU培養基中,然后過濾,用己烷洗滌,得到載藥COFs加合物。TGA分析顯示,HAPTP-TPA載藥量為20%,HAPTP -TFPB載藥量為12%,HAPTP-TFPA載藥量為13%。考慮到IBU的低溶解度,通過透析和紫外-可見分析監測解封。毒性/生物相容性測試表明,即使在100 mg mL濃度下,COFs的毒性較低。
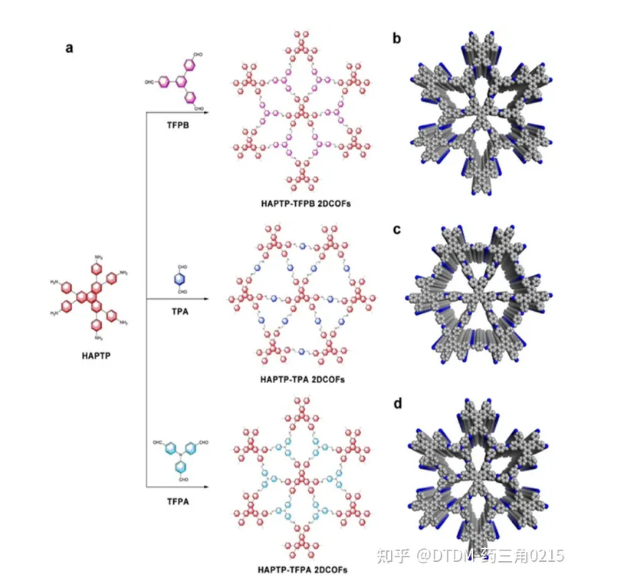
圖.8 COFs合成途徑示意圖。(b-d) COFs的可能三維結構。(顏色代號:灰色,C;藍色,N。為清晰起見,省略氫原子)
4.4
Qiu和Shan等報道了PI-COF-4和PI-COF-5兩種3D COFs的制備。PI-COF-4/5具有一個四面體頂點的菱形網絡,該網絡是通過亞甲基化將線性單元和四面體單元結合得到的。焦二酸酐(PMDA)與四面體1,3,5,7-四氨基金剛烷(TAA)和四(4-氨基苯基)甲烷(TAPM)反應,分別得到PI-COF-4/5的三維骨架。PI-COF-4的BET表面積為2403 m2 g1, PI-COF-5的BET表面積為1876 m2 g1。PI-COF-4的孔徑為13 ?, PI-COF-5的孔徑為10 ?。之所以選擇IBU作為COF結構中包裹的藥物,是因為其空腔足夠大,可以吸收IBU分子(圖9)。將PI-COFs浸入正己烷溶液中以裝載藥物,這一點得到了各種分析工具的證實。ibu包封PI-COF-4的BET表面積為1085 m2 g1, PI-COF-5的BET表面積為699 m2 g-1。與PI-COF-4相比,PI-COF-5的孔徑較小,因此釋放速率較低。通過紫外可見光譜分析測量了藥物釋放譜,其中PI-COF-4的釋放量為60%,而PI-COF-5在12小時后釋放量為49%。在加載后6天內,COFs釋放了初始封裝ibu的95%。這些結果使我們好奇PI-COFs在活細胞/體內系統中對藥物遞送的生物適用性。
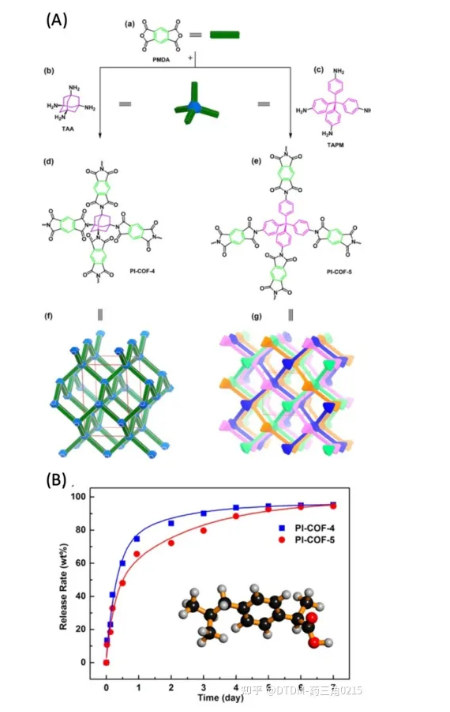
圖.9 (A) PI-COFs的合成策略;(a)-(e)非互穿3D框架(f)互穿3D框架(g)鉆石網的3D框架 (B) cofs的藥物釋放概況
4.5
Kumar等人報道了在室溫下使用1,3,5-三(4-氨基苯基)苯和1,3,5-苯三乙醛在催化量下以1:1的比例與冰醋酸合成亞胺連接的COFs,并使用不同的光譜技術證實了這一點。將IBU裝入正己烷溶液中的COFs中。COFs在室溫下用正己烷浸泡72 h,過濾、洗滌、干燥備用。RT-COF-1的BET表面積為468 m2 g-1,載藥后減小至117 m2 g-1。卸載在磷酸鹽緩沖鹽水(pH為7.4)中進行,在37℃下連續攪拌2小時。分析顯示溶液中藥物釋放量約為33%。
4.6
Yu等人通過三角單體三(4-氰atophenyl)-1,3,5-三嗪與氰酸酯連接,合成了NOP-14。二苯基砜中不同量的TCTZ可產生多種COFs,即NOP-14@10%, NOP-14@5%, NOP-14@2%和NOP-14@1%。NOP-14@1、2、5、10%系列的BET比表面積分別為32、144、78和25 m2 g-1。采用MTT法研究COFs的生物相容性。通過浸漬IBU和COFs將IBU裝入己烷中,并通過UV-Vis分析監測。采用TGA、PXRD、元素分析等方法對載藥量進行分析。N2吸附無殘余孔隙,表明COFs孔隙中有藥物負載。分別為NOP-14@10 wt%、NOP-14@1 wt%、NOP-14@2 wt%和NOP-14@5 wt%,分別為54.83%、37.06%、38.62%和50.75%。在模擬體液中進行卸載,并使用紫外可見分光光度計進行監測,顯示其在8小時內釋放。在NOP-14@2 wt%的情況下,50%的藥物釋放大約需要5小時,而在72小時內,所有藥物被釋放。
4.7
除Schiff堿型COFs外,Zhu等人還報道了氯氰尿酸與哌嗪一步聚合合成PAF-6的方法。反應**初在冰浴中進行4小時,隨后將溫度緩慢升高至90℃。PAF-6的形成是通過不同的分析儀器技術,如FT-IR和13C固體核磁共振來證實的。PAF-6的表面積為182.7 m2 g-1,呈二維有序結構,孔徑均勻,為11.8 ?。對PAF-6進行MTT試驗,發現PAF-6幾乎沒有細胞毒性。采用PAF-6在己烷介質中加載IBU藥物,并在pH 7.4 SBF下監測其釋放。完成50%的交付需要近5個小時,而在46小時內,幾乎所有的封裝材料都被釋放出來。藥物在活細胞/體內系統中的傳遞將是值得探索的。
5. COFs對胰島素的遞送給藥
糖尿病影響了近10%的人口,自1980年以來發病率翻了兩番,使其成為**第七大死亡原因。在1型糖尿病的情況下,它是由胰腺b細胞胰島不能產生胰島素引起的,而對于2型糖尿病,產生的胰島素不能被身體使用。因此,將胰島素注射到體內是治療糖尿病**有效的方法之一。口服胰島素在這方面是一種革命性的方法,因為它的非侵入性治療調節,沒有副作用,例如,自注射疼痛或頻繁皮下注射引起的焦慮。有利的是,口服胰島素可以通過肝臟到達/擴散,這類似于生物合成的胰島素。然而,注射胰島素可影響外周高胰島素血癥。口服胰島素面臨的主要挑戰是其在胃腸道中的溶解度和/或穩定性、生物利用度等。因此,需要以目標為導向的胰島素遞送。
5.1
Trabolsi等人報道了裝載胰島素的tta - dfp - nCof的制備。據報道,COF的BET表面積為384.5 m2 g1。胰島素負載由復雜的儀器支持監測,例如,對胰島素上清溶液進行核磁共振分析,其中1h -核磁共振信號的減少趨勢是藥物負載的明確證據。采用熒光素異硫氰酸酯(FITC)標記胰島素,便于熒光光譜法監測胰島素的卸載情況。COF顯示出大約65% wt%的胰島素負荷能力。通過BET表面積分析監測負載情況,在胰島素負載后,其表面積從384.5減少到12 m2 g-1,非常顯著。胰島素加載后的PXRD圖是平坦的,說明胰島素加載后,COF層的周期性受到影響,失去了結晶度。胰島素負荷的減少反映在COF的信號減少,而不是PXRD信號微弱或無信號,這支持了胰島素負荷導致信號平坦的假設。胰島素的分子大小為2.5-3 nm, COF的孔徑為1.7nm。因此,可以得出結論,胰島素分子被嵌入到COF層中,而不是內化在COF的孔隙中。在PBS (10 mM, pH 7.4)中分別以不同的葡萄糖濃度0、1、3和5 mg mL-1作為對照、正常和糖尿病狀態,檢測高血糖觸發的藥物釋放。在對照條件下,12%的藥物被釋放,表明胰島素釋放緩慢。在高血糖狀態下(3 mg mL-1), 100%胰島素在7.5小時內釋放。通過口服途徑給藥胰島素負載的COF給藥鏈脲佐菌素誘導的糖尿病大鼠,血糖水平在2-4小時內逐漸持續降低,胰島素生物利用度高,無全身毒性(圖10)。
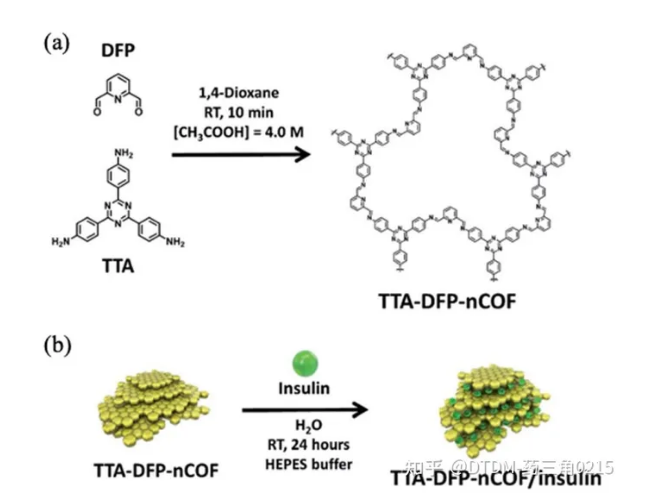
圖.10 (a) tta - dfp - nof的化學結構和合成路線;(b)胰島素嵌入COF的示意圖
5.2
Jia和Gao團隊報道了通過Lewis/Br?nsted型相互作用(N: →B),合成了硼氧聯苯COFs,即COF-1 [(C3H2BO)6·(C9H12)1]和COF-5 (C9H4BO2),用于包封葡萄糖氧化酶(GOx)和胰島素(Ins)。此外,用異硫氰酸熒光素(FITC-PEG)標記的PEG對COFs進行后合成功能化,從而在水介質中形成所需的產物。通過TGA、PXRD、TEM、SEM、CLSM等精密分析工具對FITC-PEG-COF-5@Ins-Gox和FITC-PEG-COF-1@Ins-GOx進行了分析。胰島素在COFs中的包埋導致其孔體積和表面積的減少;然而,FITC-PEG-COFs尺寸沒有發生變化。在葡萄糖濃度高的情況下,葡萄糖通過孔進入COFs。然后它與Gox反應,導致葡萄糖選擇性氧化為葡萄糖酸,**終降低pH值,導致支架分解。因此,胰島素的釋放有助于降低血糖水平。A549細胞的細胞成像數據顯示,聚合物- cofs被有效吸收,24小時后細胞存活。進一步,在1型糖尿病小鼠模型中研究了聚合物-COF的體內適用性,結果表明COF復合物對高血糖狀況有快速反應,并具有監測血糖水平的功能。此外,硼的聚合物- cof復合材料在向A549細胞遞送天然蛋白質方面表現出一致的行為。
6. COFs對其他藥物的遞送給藥
基于上述系統的討論,另一個問題是了解COFs傳遞其他藥物分子的能力,如槲皮素、吡非尼酮、順鉑和伊立替康等。我們搜集了關于幾種藥物分子被COFs遞送的攝取和釋放的相關進展。
6.1
Lotsch等人報道了TTI-COF的制備,用于槲皮素(3,3‘,4’,5,7-pentahydroxyflavone)的靶向包封/脫膠囊。采用三嗪三苯基胺和三苯基醛在三甲苯/二惡烷(1:1,v/v)中以1:1的比例制備了TTI-COF,并通過NMR、FT-IR和PXRD等分析工具對其進行了驗證。測得BET表面積為2197 m2 g-1。TTI-COF表現出綠色發光,槲皮素的存在使其猝滅,Stern-Volmer常數為1.65 * 10 7 m-1 (Ksv)。在THF培養基中載藥16 h,然后過濾/洗滌。BET分析顯示,COFs的表面積減少到56 m2 g-1,表明COFs的孔隙被填充。幾何優化顯示藥物分子沿COF孔壁垂直排列,其中藥物的多酚性質與TTI-COF的希夫堿氮進行H鍵相互作用。用人乳腺癌細胞系MDAMB-231細胞檢測藥物卸載。通過熒光顯微鏡監測信號,顯示藥物修飾的COF處理后細胞凋亡。用非癌性人乳腺上皮細胞mcf10a測定了COF的生物相容性.
6.2
Akyuz報道了用于遞送卡鉑的亞胺基二維COFs的合成。這種分子作為*腫瘤分子被認為是治療癌癥的藥物。以1,3,5-三甲基苯(TFB)和3,3‘ -二甲氧基聯苯胺(DMB)為原料合成了二維COF。在對COF進行表征后,將其用于卡鉑的裝載和隨后的遞送。實驗分析表明,該藥物在二維COF中的載藥量為-30%。卸載實驗在(a) pH 7.4和(b) pH 5.0的不同pH介質中進行120 h。結果表明,pH為5.0時,藥物卸荷量大于pH為7.4的培養基;這是因為在酸性介質中,藥物與COF之間的氫鍵相互作用變弱(圖11)。理論分析了藥物與COF分子的相互作用。觀察到藥物與COF之間形成氫鍵和CH -π鍵,形成主客體化合物。
圖.11 一些具有代表性的COF支架被用于向靶點遞送多種藥物
6.3
盡管該領域的大部分工作都集中在針對癌細胞,但Zhang等人的研究小組考慮了細胞外基質(extracellular matrix, ECM),它是由血管、腫瘤細胞和非腫瘤細胞組成的復雜系統陣列。考慮到ECM在藥物遞送到癌細胞方面的關鍵作用,該小組開發了一種功能性的基于ZCOF的ECM消耗納米系統來增強腫瘤PDT。在本研究中,吡非尼酮(PFD)作為*纖維化藥物以1[4,4',4''-(1,3,5-三嗪-2,4,6-三基)三苯胺(TTA)]和2[2,5-二羥基對乙醛(DHTA)]為反應試劑制備的希夫堿COF為載、卸藥試劑。然后用兩親性聚合物聚(乳酸-羥基乙酸)-聚(乙二醇)(PLGA-PEG)得到PFD@COFTTADHTA @PLGA-PEG,簡稱PCPP。COF的表面積為2831 m2 g-1,孔徑為-3.67 nm。PCPP在pH 7.4的PBS中孵育72 h (3 d)后,其有效藥物釋放率為-74%。在CT26荷瘤小鼠模型中,PCPP選擇性地在腫瘤細胞內積累,并降低腫瘤的轉移水平。
6.4
Chatterjee和Bhaumik等人報道了通過希夫堿反應合成TRIPTA-COF。其BET表面積為1074 m2 g-1。隨后,TRIPTA-COF裝載順式鉑,裝載量為31.19%。MDA-MB-231細胞僅接受順鉑和順鉑負載的COF治療,分析顯示順鉑負載的COF對癌細胞的抑制作用高于原始順鉑治療。順鉑負載的COF被癌細胞內化,可以很容易地在細胞內傳遞藥物,增加順鉑的細胞毒性。在這里,值得一提的是單獨的COF對癌細胞的生長基本沒有影響;然而,靶向COF包封/介導的順鉑比原始順鉑表現出更好的抑制作用。
6.5
Guan等人報道了用顏料Orange 71合成共價三嗪有機骨架。BET的表面積為960 m2 g-1。考慮到伊立替康(iinotecan, CPT-11)的生物半衰期為6-12 h,我們選擇了用于晚期結直腸癌的伊立替康(iinotecan, CPT-11)在共價三嗪有機框架中進行負載。因此,在應用過程中,該藥物的控釋是非常必要的。在pH為6.8的PBS培養基中,以1:1的比例混合COF和藥物進行上樣,熒光光譜監測。在pH為5.4、6.8和7.4的三種溶液中進行負載,其中pH為6.8時負載**高。載重量為27.9 wt%。卸載在37℃下進行,緩沖介質的pH值分別為7.4、6.8和5.4。pH為7.4時,24 h和48 h的卸載效率分別為4.8%和21.1%左右。在酸性介質中,pH值為6.8時,48 h后釋放率為74.9%,pH值為5.4時,釋放率為56.7%。由此可以認為,該探針具有作為pH響應性藥物載體的能力。
6.6
Dinari及其同事采用共價三嗪基聚合物(CTPs)作為藥物載體。4,4‘,4’‘ -((1,3,5-三嗪-2,4,6-三基)三氮二基)三苯甲酸與3,30 -二氨基聯苯胺反應,即BZ-CTP的溶劑熱合成方法。據報道,多孔聚合物具有高表面積和熱穩定性(在800℃時僅損失樣品重量的19.3%)。采用FTIR、元素分析、SEM、TEM和粉末XRD對ctp進行了分析。SEM顯微圖顯示,化合物具有-139 nm大小的球形顆粒,這主要是由于BZ-CPT片間的π-π堆積力所致。此外,BET研究表明,微孔的表面積為-681 m2 g-1。該組以吡羅西康(PRX)和甲氧胺酸(MFA)作為非甾體*炎藥,證明了BZ-CTP的藥物負荷。這些藥物在水中的溶解度很低,導致藥物的生物利用度較低,如果長期高劑量使用會產生不良反應。為PRX和MFA找到合適的載體有可能提高它們的效率,并將防止使用有毒的處理劑量。藥物(0.1M DMF溶液)加載成功,分別以53%和49%的載藥量獲得PRX@BZ-CTP和MFA@BZCTP,并采用多種光譜技術對其進行分析。MFA@BZ-CTP和PRX@BZ-CTP在PBS中的體外釋放行為表明,在24和96 h內,MFA的釋放量分別為-92%和-81%然而,**,該平臺尚未在細胞或體內進行研究。
6.7
Dinari及其同事報道了用對羥基苯甲醛和三聚氰尿酸單體單元制備聚亞胺基共價三嗪骨架(PI-CTF)。PI-CTF的表面積為856 m2 g-1。在DMF中完成了前列腺癌藥物索拉非尼(SFN)的裝載,裝載效率分別為83%和98%。在PBS中研究了藥物的卸載,當pH從7.4降至5.3時,藥物的釋放率更高。LNCaP細胞在暴露48和72 h后,使用原始SFN和SFN@PI-CTF的MTT試驗研究其體外細胞毒性,兩者表現出相似的細胞毒性。
6.8
Chen和同事們報道了通過改變單體或溶劑的濃度來合成具有多種拓撲結構的COFs。采用兩種雙官能單體,即以聯苯為基礎的{3,5-雙(對氨基苯基)- 3’,5‘ -雙[4-(5’‘,5’‘-二甲基-1’‘,3’‘-二惡烷-200基)苯基]-聯苯(BABN)和3,5-雙(對氨基苯基)- 30,50 -雙(4-甲酰苯基)-聯苯(BABF)}。在不同溶劑如二氯甲烷或三甲苯溶劑中得到了由六角形/三角形雙孔(DP)或具有菱形方形(sql)單孔(SP)支架(BABN-DP)組成的kagome (kgm)晶格。所獲得的COF能夠分別裝載布洛芬和卡托普利藥物,并在pH為7.4的模擬體液中監測其釋放速度。7天后,BABN-DP COF顯示卡托普利釋放率為87.6%,而IBU的釋放率為62.4 wt。
6.9
Wang等人報道了用對苯二醛和四(對氨基苯基)卟啉反應合成COF-366。BET的表面積為1240 m2 g-1,加入*癌藥物plumbagin后,BET的表面積降至560 m2 g-1。紫外-可見驗證了載藥效率為54.3%。將含plumbagin的COF-366浸入PBS溶液中,并在室溫下監測pH為5.5和7.4的遞送情況。在pH為5.5時,93%的載藥在72小時后被遞送,而在pH為7.4時,遞送速度較慢。ph控制的遞送是由于COF-366的溶解,其中COF-366在酸性條件下被部分破壞,可見其BET表面積在藥物卸載后減少到420 m2 g-1。
6.10
他等人報道了OC-COF[一種**佳可生物降解的交聯共價環糊精框架]的合成,作為ROS信號干粉吸入器(DPI)載體在急性肺損傷(ALI)治療中的應用。首先,將g-環糊精(g-CD)修飾為相應的CD-MOF。其次,將g-CD與草酰氯(OC)一鍋交聯,得到立方形貌尺寸在2 ~3mm范圍內的OC-COF。因此,該工藝在COF中引入了ros響應鍵。OCCOF進一步加入過草酸酯鍵作為過氧化氫清除劑,它可以水解正常到內溶酶體的pH變化,消除炎癥部位產生的ROS,這從引入OC-COF后對H2O2處理的MHS細胞的細胞分析中可以看出。由于其清除H2O2的能力,200 mg mL-1 OC-COF可以保持細胞活力。在WI26- VA4、A549、Calu-3細胞和SD大鼠中也證實了COF的生物相容性。此外,內化的OC-COF是可生物降解,通過肝臟和腎臟代謝排出體外。在OC-COF中引入*炎*氧化藥物川芎嗪(ligg)治療ALI,得到DPI LIG@OC-COF。在ALI大鼠中,吸入五分之一LIG劑量的LIG@OC-COF可明顯緩解炎癥、氧化應激和肺損傷。
6.11
Jiang及其同事報道了在支架中含有偶氮鍵的低氧敏感COF的合成。它具有納米級的尺寸,并配有不同的光敏劑,即缺氧活化藥物替拉帕胺(TPZ)和氯e6 (Ce6)。COF以4,4-偶氮二氨基苯(AD)和1,3,5-三甲酰-2,4,6-三羥基苯(TP)為原料制備,并通過幾種光譜技術進行了分析。合成的COF的表面積為630 m2 g1,孔徑為B2 nm。利用COF完美的結晶度和均勻的孔隙率來負載Ce6和TPZ藥物,然后用甲氧基聚乙二醇胺對其表面進行修飾,得到TA-COF-P@CT。腫瘤微環境過度表達偶氮還原酶。因此,為了評估TA-COF-P@CT對偶氮還原酶的體外反應性,將已知的偶氮還原酶仿生化合物Na2S2O4與TA-COF-P@CT在37℃的水溶液中充分混合,使TA-COF-P@CT中TPZ的熒光信號增加了10倍。在4T1細胞中研究了TA-COF-P@CT的細胞攝取,其中TPZ(紅色)和Ce6(綠色)的熒光信號在細胞質中共定位。此外,低氧處理后TPZ的信號強度(紅色)比常氧處理增加了2.2倍,這確實證明了低氧微環境可能導致TA-COFP@CT的分解和TPZ的快速釋放。此外,我們還發現,與TA-COF-P@CT孵育并暴露在光(650 nm, 3 min)下的細胞比沒有光照射的細胞顯示出更高的熒光輸出。(圖.12)
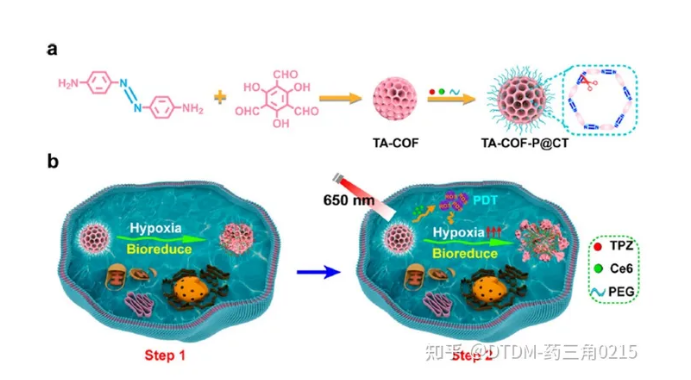
圖.12 (a) TA-COF和TA-COF-P@CT的合成; (b)通過光激活途徑的低氧敏感藥物遞送
該實驗還觀察到Ce6在4T1細胞缺氧誘導后增加ROS生成的能力(圖13)。在4T1異種移植物荷瘤BALB/c小鼠中也研究了TA-COFP@CT的體內腫瘤靶向能力。在光照下,TA-COF-P@CT小鼠組對4T1腫瘤生長表現出**的抑制作用。腫瘤生長幾乎被抑制,考慮到腫瘤質量/大小等參數,TA-COF-P@CT具有較好的*腫瘤效率。為探討TA-COF-P@CT的影響,對不同臟器進行蘇木精和伊紅(H&E)染色分析,脾、心、肝、腎、肺等臟器未見明顯組織學異常。結果表明TA-COF-P@CT的處理不會對小鼠的正常器官造成任何額外的損傷Gong等人證明了COF是一種有效的癌癥饑餓治療平臺。本文報道的COF是用以下前體合成的:(i) TPA-CHO: π - π共軛三(4-甲酰苯基)胺和(ii)聯苯胺。合成的COF的表面積為24 m2 g-1,平均孔徑為-30 nm。葡萄糖氧化酶(GOx)和l -精氨酸(Arg)在純水中負載。經Rho B-COF處理后,COF的納米級形狀可以被HeLa細胞內化。在腫瘤細胞中,葡萄糖的分解和葡萄糖酸和H2O2的產生是由GOx催化的。產生的H2O2隨后與L-Arg反應生成NO,從而抑制腫瘤細胞增殖。在細胞中,通過4-氨基-5-甲氨基- 2’,7‘-雙乙酸二氟熒光素等熒光探針驗證了NO的產生,熒光隨著COF + GOx + L-Arg(即NO)濃度的增加而增強。作者還通過MTT實驗證明了COF的無毒性和COF + GOx + L-Arg的極端細胞毒性。發現細胞凋亡的機制是溶酶體損傷。在帶瘤小鼠體內實驗結果表明,COF + GOx + L-Arg具有抑制腫瘤和*遷移的作用。
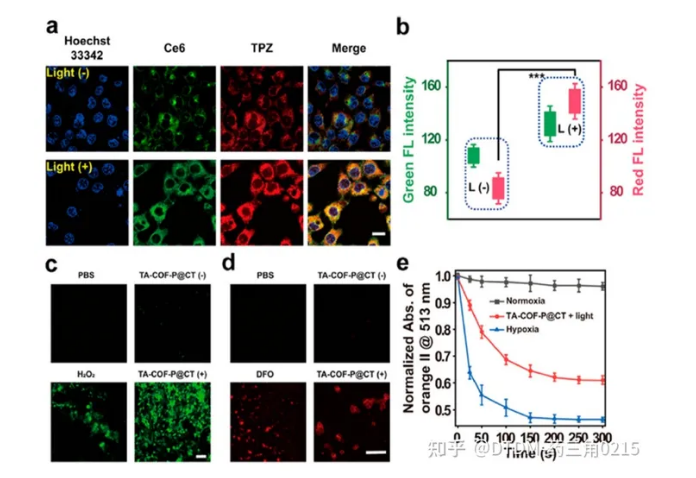
圖.13 共聚焦顯微鏡下的4T1細胞(a) TACOF-P@CT,帶燈或不帶燈。(b)歸一化熒光強度為Ce6(綠色)和TPZ(紅色);(c)在有光或無光條件下,用TA-COF-P@CT孵育的4T1細胞識別細胞內的ROS。陽性對照:H2O2。(d)在有光或無光條件下,用TA-COF-P@CT孵育4T1細胞的缺氧識別。陽性對照:DFO(1,8-二氮芴-9- 1);
注:(e)橙II在513 nm處的歸一化吸光度。細胞核標記Hoechst 33342。比例尺(a)為20毫米,(c)和(d)為100毫米
6.12
Han和他的同事報道了用黑色素作為模擬血小板支架的卟啉基COFs的制備。核殼melanin@porphyrin-COF (MPC)的比表面積為638.4 m2 g1,孔徑為16.4 ?。水蛭素藥物被melanin@porphyrin-COF包裹,再用小鼠血小板膜包裹,**終制備HMPC@PM。血小板膜具有血栓寄存特性,制備的HMPC@PM可以靶向血栓區域,隨后開啟熱療。在近紅外光下,這將導致ROS的產生。采用1064 nm體外激光輻射評價HMPC@PM光熱效應。將HMPC@PM血塊與新鮮血液一起孵育觀察溶栓效果,然后激光照射20min,使血栓因溶解增強而破壞。
6.13
也有報道多孔共價三嗪骨架(CTF)的合成以及*癌藥物伊馬替尼(IMA)的負載。在PBS中進行體外卸載,pH為5.3時卸載量高于pH為7.4。對正常細胞(L929細胞)和癌細胞(K562細胞)進行細胞毒性評價。IMA@CTF在孵育48小時后對癌細胞表現出嚴重的毒性,但對正常細胞沒有毒性。
6.14
Botela等人報道了一種2D-COF的制備,該2D-COF具有合成后修飾的通用性,可獲得各種COF類似物。采用HHTP(2,3,6,7,10,11-六羥基水合三苯)和BDBA(苯-1,4-二硼酸)在三甲苯和1,4-二惡烷的介質中以1:1 (v/v)的比例縮合合成COF-5。用2-氨基苯-1,4-二硼酸(BDBN)代替BDBA,對該分子進行重構,得到CF-x (x = 25-100)。在COF系列中,CF-25的BET表面積**高,為1791 m2 g-1。在DCM中攝取*腫瘤藥物喜樹堿(CPT),并在PBS緩沖鹽水培養基中卸載。在不同的細胞系(如HeLa細胞)中也監測了遞送,這表明cof藥物部分可能在溶酶體中內吞,正如溶酶追蹤器所支持的那樣。
7. COFs作為多種藥物載體
研究人員在試圖揭示COFs的多任務處理能力,這可以讓人們更好的了解它們單獨加載/卸載多種藥物的潛力。這種多功能性可以重新構建,并促使我們重新思考在這一當代領域投入更多的研究,以提高它們在更簡單,更順暢的環境中卸載藥物的功效。
7.1
Shi等人報道了一種基于籠型支架,即籠-COF-TT,其中(TT =三氨對苯二甲酸)用于輸送IBU、5-FU和卡托普利(CAP)。在COF中分別添加IBU、5fu和CAP后,原始COF (672 m2 g-1)的N2吸附等溫線分別降至313、256和218 m2 g-1。在pH為7.4的磷酸鹽緩沖鹽水中,通過紫外-可見光譜法測定藥物釋放譜。52 h后,IBU-、5-FU-和cap-負載-COF的初始釋藥量分別為93%、93%和94%。
7.2
Zhai, Zheng, Mi 等人報道了用席夫堿反應合成DF-TAPB-COF和DF-TATB-COF兩種氟化COFs,其中DF-TAPB-COF呈球狀,DF-TATB-COF呈顆粒狀微觀結構。氟基團的存在促進了與客體藥物分子的氫鍵,**終導致更高的藥物負載。DF-TATB-COF的BET表面積為1720 m2 g-1,計算DF-TATB-COF的BET表面積為963 m2 g-1。將具有降壓作用的5-FU和卡托普利(captopril, CAP)裝載在COFs中,通過TGA、FT-IR和PXRD等多種分析方法監測。 DF-TAPB-COF 和 DF-TATB-COF分別裝載其中一種靶向藥物,即5-FU,分別顯示69%和67%的載重量。在CAP的情況下,DF-TAPB-COF和DF-TATB-COF的負荷分別為60%和41%。卸載在PBS培養基中進行,溫度為37℃,溶液pH為7.4。3天后,DF-TAPB-COF加合物中80%的5-FU的輸送量高于DF-TATB-COF加合物。在B16F10細胞中使用羅丹明B染料監測兩種COFs的內吞作用,顯示它們成功被細胞攝取。
7.3
Wang及其同事報道了一種基于甲氧基共價有機框架(mCOF)的阿霉素(DOX)和喜樹堿(CPT)遞送系統的制備。具體來說,用1,3,5-三-(4-氨基苯基)苯(TAPB)和2,5-二甲氧基對苯二甲酸(DMTP)制備的mCOF平均孔徑為2.25 nm, BET表面積為682.3 m2 g-1。在mCOF中加載CPT后,表面面積從682.3 m2 g-1減小到521.6 m2 g-1 為了實現納米載體的生物相容性和特異性線粒體靶向,不同的標簽,如DSPE-PEG2000-NHS[聚(乙二醇)-氨甲酰二硬脂酰磷脂酰乙醇胺]和DOXHCl反應形成DOX-脂質。然后CPT@mCOF被dox -脂質、雙棕櫚酰磷脂酰膽堿(DPPC)和膽固醇琥珀酸單酯(CHEMS)包裹成脂質層。在37 1C的PBS (pH 7.4和5.0)中,進行CPT@mCOF、@ dox -脂質藥物釋放實驗觀察到pH反應性,兩種藥物均顯著釋放。COF@liposome顯著增加4T1細胞中的活性氧水平,**終抑制4T1細胞誘導的BALB/c腫瘤生長小鼠模型。
7.4
Fang和Negeshi等人報道了另一種非常有趣和值得注意的COF(TUS-64),他們將5,10,15,20-四基斯(4-氨基苯基)卟啉(TAPP)與2,3,6,7,14,15-六基斯(40 -甲酰苯基)三苯(HFPTP)在120℃下連接3天,在6 M醋酸溶液/1,4-二氧六環/三甲苯(1:3:7,v/v)的溶劑混合物中以2:3的摩爾比合成。其BET表面積計算為1632 m2 g-1。COF用于裝載/卸載藥物,如(a) 5-FU(*癌藥物),(b)溴莫尼定(治療青光眼),(c)異煙肼(*結核),(d) CAP(*高血壓和心力衰竭藥物)和(e) IBU。在CAP、溴胺、5-FU、IBU和異煙肼的作用下,原始TUS-64 COF的比表面積分別降至78.4、501.8、378.7、869.3和610.0 m2 / g。37℃時,載藥COF保存在半透袋中,浸泡在pH 7.4的磷酸鹽緩沖液中。在每個時間間隔,通過UV-Vis分析監測卸載。在CAP的情況下,12小時后,6%的藥物被釋放,而2天后,大約92%的藥物被卸載。在IBU病例中,12小時后的遞送率為40%,6天后的遞送率為67%。異煙肼24 h釋放率為16%,延長10 d釋放率為22%。溴莫尼定的遞送率約為35%(6天)。5-FU給藥9天后遞送率為12%。
注:在pH5和pH7.4條件下對其進行了遞送試驗。利用N2吸附和PXRD對藥物的卸載譜進行了監測。
8. 小結與展望
圖.14 一些具有代表性的COF支架被用于向靶點遞送多種藥物
COFs是一種具有廣泛功能的有機多孔材料,具有生物相容性、易于功能化、可調節的幾何形狀和開放的孔隙結構等優點。COFs已經在不同的研究領域得到了廣泛的研究和應用,**終在推進領域和應用技術領域發揮了重要作用。COFs 系列多孔材料向我們展示了生態友好、兼容和環境危害小、并作為治療幾種疾病的藥物傳遞載體的**新進展。它們在生物醫學上的應用包括生物大分子固定化、藥物包封/解封以及光動力和光熱治療。本文精確地討論了藥物分子(DOX, ibu,胰島素等)的包封/解封(圖14),并對細胞內遞送特別給予關注。一系列文章的解讀,目的是為了解藥物包封/解封的現狀,從而導致藥物在生物介質中傳遞,如表1所示。除了COFs有趣的結構參數外,本文還強調了與遞送過程相關的生物學過程。

表.1-1 COFs藥物遞送載體匯總
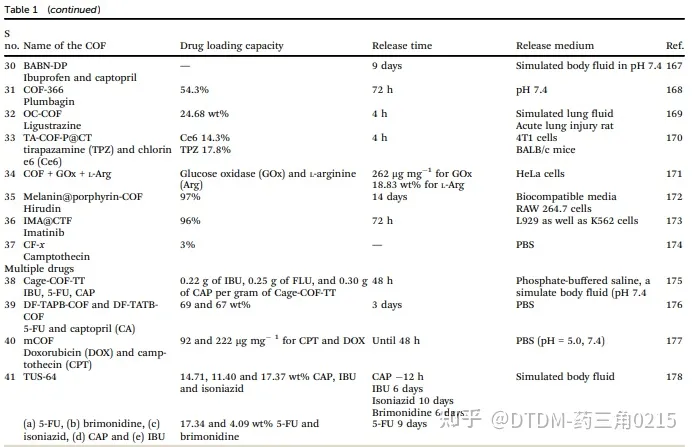
表.1-2 COFs藥物遞送載體匯總
通過討論,我們了解到藥物包封一般是在溶劑介質中進行,將COF與藥物分子攪拌在一起進行包封,然后將載藥的COF進行卸載。有時僅在溶劑中或在活細胞中監測脫膠囊。改變卸藥介質的pH值會影響卸藥效果。在TAPB-DMTP-COF的情況下,在pH為5或6.5時,大部分藥物在前兩個小時內被卸載,而在pH為7.4時,同樣的情況為40%。DOX@COF的形態在2 h內由球形變為不規則塊狀,其連接發生斷裂,這可能引發藥物的卸載。在SS-COF的情況下,在pH為5的PBS中引入10 mM谷胱甘肽導致藥物脫離膠囊。在COF@IR783@CAD的情況下,24小時后發現PBS中的卸載量為-48.2%。通過流式細胞術和共聚焦顯微鏡觀察4T1細胞的細胞攝取情況。孵育96 h后, DiSe-Por的DOX脫囊率為27.9%,pH為7.4時降了42.4%。在pH 5.0時,TpASH在72 h內釋放74%的藥物。NOP-14@2 wt%時,IBU藥物在B5 h內釋放50%,而在72 h內釋放全部藥物。總之,我們知道降低pH值可以將藥物從COF支架中釋放出來。在少數情況下,釋放發生在COFs的支架坍塌。我們注意到COFs在生物相容性、形態、穩定性、藥物釋放控制、生物降解性以及與不同藥物類型的相容性等幾個參數方面的生物醫學用途的優勢。探討了幾種COFs的生物相容性。在TpASH的情況下,使用乳腺癌細胞株(MDA-MB-231)進行MTT試驗來探索其細胞毒性,該細胞株在COF存在下顯示了細胞活力。另一個例子是NOP-14,其中MTT試驗用于探測其低毒性。以非癌性人乳腺上皮細胞mcf10a為研究對象,探討TTI-COF的生物相容性。另外,HAPTP-TPA即使在100 mg mL1的濃度下也表現出低毒性。OC-COF在WI26-VA4、A549、Calu-3細胞和SD大鼠中的生物相容性也得到了證實。與PI-COFs-2/3在200 mg mL-1濃度下孵育24 h后,裸COFs的存活率超過80%。綜上所述,這些結果有助于建立COFs的生物相容性并支持其在該領域的進一步應用。
關于COFs的形貌,一個關鍵的問題是它們的粒度。如前所述,為了有效的細胞攝取,需要200納米的尺寸。不同版本的PEGCCM@APTES-COF-1被發現是單分散的,尺寸分別為PEG350-CCM@APTES-COF-1的150 (±8)nm, PEG1000-CM@APTES-COF-1的170 (±7)nm和PEG2000-CCM@APTES-COF-1的230 (±10)nm。不同的聚乙二醇密度導致不同的形態。在Liu小組的另一個例子中,所得到的COF被發現是球形的,平均直徑為30-40納米。發現OC-COF具有立方形態,尺寸在 2-3mm范圍內。另一個參數是COFs的表面積,其中TAPB-DMTPCOF顯示的表面積為1000 m2 g-1。SSCOF的面積為672 m2 g-1,低于TCOF的58.871 m2 g-1。PI3-COF的BET表面積為1000 m2 g1, PI-2-COF的BET表面積為1700 m2 g-1。DiSe-Por 的表面積為73.5 m2 g-1,載藥后減小到7.9 m2 g-1。COFs的表面積是藥物裝載的一個很好的指標/標記,一旦藥物裝載,COFs的表面積就會減少。
可降解性是使用COFs給藥的重要性質,其中支架在藥物釋放前的降解是一個問題。或者,如果作為遞送載體的COFs在藥物遞送后沒有降解,這可能會導致生物環境中的副反應。例如,TAPBDMTP-COF在PBS介質中表現出希夫堿鍵的降解,從而導致藥物傳遞。劉課題組報道了具有生物降解性的COFs的合成。當pH設置為6時,藥物脫囊率高于pH 7.4,表明COF支架降解。在COF DiSe-Por中,受pH和GSH的影響內化后,支架的C=N和Se-Se鍵被劈開,**終幫助藥物釋放。OC-COF是可生物降解的,并在卸載藥物后從體內消除,作為具有可生物降解性的COFs的一個完美例子。與其他COFs類似,同樣的生物降解需要檢查作為生物材料的適用性。
COFs的孔徑大小是決定多用途藥物負載的決定性因素。事實上,它們的腔體必須很大,才能容納藥物。例如,孔徑-10 ?可能有助于布洛芬等藥物的順利裝載。在PI-COF-4和PI-COF-5之間,后者的孔徑較小,因此釋放速率較低。PAF-6呈二維有序結構,孔徑均勻,為11.8 ?。以TTA-DFP-nCOF為例,測得其孔徑為1.7 nm,靶藥胰島素的分子大小為2.5-3 nm。因此,胰島素被嵌入到COF層中,而不是內化在其毛孔中。
雖然研究人員在這一方向取得了顯著進展。但是,COFs在體外和體內生物醫學用途方面仍然表現出幾個基本缺點,如下:
(a)它們在細胞內的內化模式尚不清楚。很明顯,drug@COF加合物是內化的;然而,從文獻報道來看,內化的途徑并不明確。在這種情況下,通過共標記溶酶體、線粒體等進行明確的研究將有助于進一步追蹤傳遞;
(b)一些關于COFs的文章報道了藥物傳遞過程中的鍵裂解。因此,COF支架有可能坍塌成幾個小的有機碎片或聚合物碎片,這可能在體內引起嚴重的毒性。因此,強烈建議在體外和體內研究COFs的降解;
(c)在未降解的情況下,有必要了解藥物遞送后COF支架的去向,以避免細胞/體內存在外來分子;
(d)報告的結果主要討論了COFs的細胞毒性。然而,在將COFs作為體內應用的載體之前,對其毒性如神經毒性、血液相容性、遺傳毒性、對生殖系統的影響以及致癌性水平等進行詳細的研究是非常必要的;(e)藥物裝載通常在己烷、DCM或DMF介質中進行,這些介質對細胞有潛在毒性;相反,二甲基亞砜在生物上更加友好。
展望:
因此,在設計基于下一代COFs的未來探針時,可以優先考慮幾個步驟:
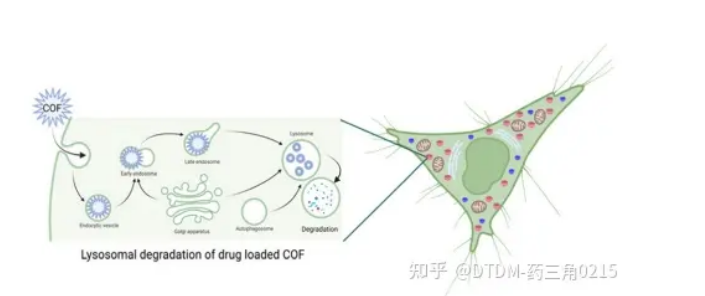
圖.15 溶酶體腔室內載藥COFs的降解,(溶酶體遞送的一個可能缺點)
A)支架:探針多采用希夫堿連桿結構。C=N容易水解,特別是在酸性環境中。這些分子的細胞遞送可能不會繞過溶酶體途徑,因此在溶酶體的低pH下,支架的水解是可能的(圖15和圖16a) 123因此,溶酶體逃逸是必要的,這可以通過幾種途徑實現,其中一種想法是通過合成后修飾在COFs表面引入足夠的正電荷.
(B)已知細胞表面帶負電荷,因此drug@COF表面帶正電荷將有助于內在化。然而,如果COF從一開始就帶正電,那么在增壓顆粒內的藥物裝載可能會有問題。因此,在這種情況下,合成后修飾是有幫助的,在藥物裝載后,可以在COF表面引入帶正電的基團。同樣,聚乙二醇(PEG)型功能分子作為溶解度標簽可以在藥物裝載后引入,以獲得更好的親水性。在未來,類似的細胞穿透肽(CPP) 和細胞穿透COFs可以被計劃/設計,然后在實驗室中合成以增強細胞傳遞(圖16b)。
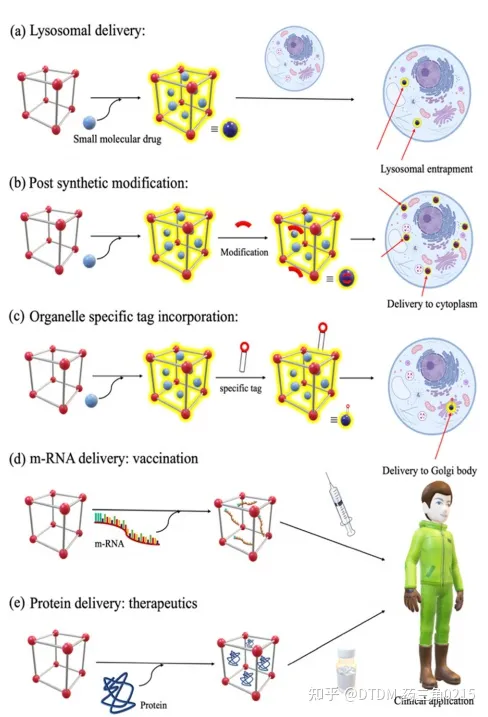
圖.16 未來COFs遞送概念
(C)考慮到遞送后探針將有機會進行蛋白水解,從而有助于消化COFs,酰胺作為主鏈的效用將是有利的。此外,用酰胺代替希夫堿可以提高生物相容性。
(D)對于靶向遞送,可以設計和合成細胞器特異性COFs,在藥物裝載后,它們的表面可以用細胞器特異性標簽進行修飾。在這里,考慮沒有膜破壞活性的細胞滲透性線粒體特異性肽是很有趣的用COFs連接標簽將導致加合物完全由細胞微環境的極性直接指向線粒體。其他細胞器也有類似的標簽,可以附著在COFs表面以制備細胞器特異性COFs(圖16c)。
(E)通常,小分子藥物是靶向遞送的。眾所周知,具有更好靶標選擇性的蛋白質治療方法目前正受到越來越多的關注;然而,由于它們的結構、溶解性或其他相關原因,它們可能難以遞送另外,m-RNA遞送作為疫苗遞送的一部分同樣非常重要。因此,作為下一代遞送劑,蛋白質或m-RNA可以作為靶標(圖16d和e)。
簡而,在多孔材料家族中,COFs是**年輕的成員。到目前為止,重點是定制合成以及多功能表面改性,合成后改性等。在藥物遞送方面已經報道了一些新結果,這些結果確立了材料成為載體的能力。現在應該把重點放在給藥領域,在這個領域我們需要知道COFs是如何影響生物參數的。我們認為,COFs的主要優點是其無金屬支架以及易于功能化和可調的幾何形狀。我們預計,在可預見的未來,COFs將成為藥物輸送領域的潛在競爭者,導致其臨床應用。




 齊岳微信公眾號
齊岳微信公眾號 官方微信
官方微信 庫存查詢
庫存查詢