蛋白質交聯劑的使用方法和應用方向(轉)
蛋白質交聯劑分為三大類:同源交聯劑,異源交聯劑,光反應交聯劑。
使用方法
圖示為同源交聯劑的使用方法:將待交聯的蛋白質A與交聯劑在一定條件下反應,得到的蛋白質A-交聯劑中間體,然后移除多余的交聯劑,再加入欲交聯的蛋白質B。產物中可能會形成多聚體,這一副產物通過調節反應條件來控制。分成兩部反應的目的在于減少分子內交聯以及形成蛋白質多聚物。另外,選擇異源交聯劑也可以減少多聚物的產生。
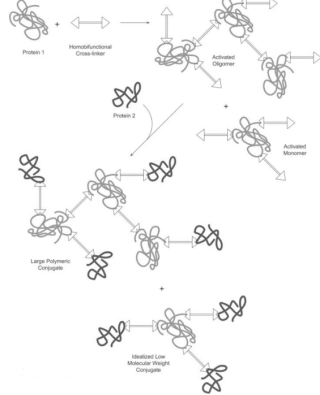
應用
蛋白質交聯劑已有廣泛應用于生命科學研究的各個分支。
蛋白質間相互作用研究
大多數蛋白質-蛋白質結合相互作用是瞬時的,通過交聯方法可以穩定或永久連接相互作用復合物中的成分,從而有助于鑒別這些瞬時接觸。一旦相互作用的成分被共價偶聯,可以使用其他步驟(例如細胞裂解,親和純化和電泳)來制備分析樣品,同時可維持的相互作用復合物。
生物導彈研究(靶向**)
將能識別**表面抗原的抗體與**共價連接,實現靶向**,從而減少傳統化療方法對健康細胞的殺傷。
載體蛋白與半抗原的連接
半抗原只有反應原性而沒有免疫原性。而將病毒包被蛋白的一段多肽序列(半抗原)可以和載體蛋白連接后制成疫苗,激發免疫反應。另外也可以通過這種方法制備單克隆抗體,并利用此單抗返回找到大分子蛋白上的抗原結合位點。在連接二者的操作中,較低的半抗原-載體蛋白摩爾比會帶來更高的抗體親和力。
此外將半抗原連接在載體蛋白中間的氨基酸上比連接在其末端時產生的的抗體效價更高。
蛋白質或其他分子的固相化
將蛋白質通過共價鍵結合在磁珠,96孔板,玻璃等等固體基質上,以減少洗脫過程中的損失。
抗體的標記、標記轉移
將抗體與酶,熒光基團或者生物素連接用于定量測量或者定位觀察。抗體標記與修飾之前,需要用固定化的抗原純化。為了避免抗體結合抗原的位點被封閉,選擇抗體重鏈上合適位置的的氨基酸就比較重要。標記酶可以連接在抗體鉸鏈區打開形成的二硫鍵上,或者或者抗體的非特異性片段上。
此外,還可以將抗體酶切,獲得抗原結合片段,然后將標記基團與抗原結合片段連接。這種方法的優勢是在ELISA反應中減少了Fc片段的干擾,并且也增加了這一復合物的膜通透性,使之更適合標記活體細胞。左圖是將標記基團結合在鉸鏈區二硫鍵打開生成的巰基上。右圖是將標記基團直接結合在抗體結合片段上。
交聯是指將兩個或多個分子通過共價鍵化學結合的過程。 交聯劑包含具有反應活性的末端,可與位于蛋白或其他分子上的特定功能基團,如伯胺和巰基反應。 蛋白和多肽上有多個化學基團可用于交聯,因此蛋白和多肽可以作為偶聯的靶標,用于使用交聯方法的研究中。
交聯劑用于確定鄰近蛋白間的關系以及配體-受體相互作用。 具有氨基反應活性的同型雙功能的交聯劑:琥珀酰亞氨酯或亞氨酸酯、以及具有氨基反應活性和光活化疊氮苯化合物的異型雙功能交聯劑是這些應用中常用的交聯劑。
交聯劑也常用于修飾核酸、**和固相載體表面。 用于氨基酸和核酸表面修飾和標記的化學原理是相同的。 該化學領域稱為生物偶聯,包括交聯、固定、表面修飾和生物分子標記。




 齊岳微信公眾號
齊岳微信公眾號 官方微信
官方微信 庫存查詢
庫存查詢