酰腙Schiff堿的[Cu(L)(Phen)]·1/4H2O (1)|(二乙胺基)水楊醛縮異煙酰腙/鄰菲羅啉銅配合物
摘要
摘要:在甲醇和DMF混合溶劑中合成了一種酰腙Schiff堿的銅配合物[Cu(L)(Phen)] ·1/4H2O (1),其中H2L=4-(二乙胺基)水楊醛縮異煙酰腙,Phen=鄰菲羅啉,經元素分析、紅外光譜、紫外光譜、熱重分析和X-射線單晶衍射分析進行了表征。1的晶體屬單斜晶系,P21/n空間群,晶胞參數a = 1.376 4(2) nm,b = 1.058 18(18) nm,c =1.6997(3) nm,α = 90)°,β = 93.244(3)°,γ = 90°,V = 2.471 6(7) nm3;Cu(II)處于四方錐配位環境,配合物通過分子間π…π和C-H??????…π相互作用形成一維鏈狀超分子。
銅是生物體內必需的微量元素,是一些重要酶的活性中心,它與有機配體形成的配合物廣泛存在于生命體中,參與電子傳遞、氧化還原等生命過程,許多銅配合物具有抗菌、抗病毒、抗炎、抗**、酶**等許多特殊的生物活性[1-7]。而銅離子配位構型的多變性,更使其配合物結構異彩紛呈。酰腙類Schiff堿不僅具有易于控制的空間構型、多齒的配位能力和很高的穩定性,還具有獨特的光、電、磁等物理材料性能以及良好的生物活性[8-14]。因此研究酰腙Schiff堿銅配合物具有重要的意義。4-(二乙胺基)水楊醛縮異煙酰腙(H2L)是一種四齒Schiff堿,目前與之相關的配合物的報道還很少[15],作為我們研究工作的延續,本文以鄰菲羅啉為**配體合成了一種銅三元配合物[Cu(L)(Phen)]·1/4H2O,報道了它的光譜性質、熱穩定性和晶體結構。
1 實驗部分
1.1 儀器與試劑
德國Elmentar Vario EL元素分析儀;美國Nicolet公司is10型FT-IR紅外光譜儀;上海美普達UV-1800PC型紫外-可見分光光度計;德國塞馳STA 409 PC型綜合熱分析儀;德國Bruker Smart Apex CCD單晶衍射儀。所用試劑均為分析純試劑,4-(二乙胺基)水楊醛縮異煙酰腙(H2L)按[15]方法制備。
1.2 配合物1的合成
將0.2 mmol鄰菲羅啉和0.2mmol的酰腙配體H2L溶于5 mL甲醇和5mLDMF的混合溶劑中,0.2 mmol的Cu(CH3COO)2 ·H2O溶于10mL甲醇,將上述溶液置于50ml的圓底燒瓶中,于60℃加熱攪拌2h,冷卻至室溫,過濾,濾液靜置一周后析出黑色塊狀晶體。對4(C29H26N6O2Cu)·H2O的元素分析實測值(理論值),%:C,62.33(62.36);H,4.65(4.69);N,15.11(15.05)。IR (KBr,σ):3411,2964,2926,1589,1511,1496,1428,1401,1355,1246,1212,1138,956,856,828,723,691 cm-1。
1.3 晶體結構測試
選取1的0.20 x 0.22 x 0.24 mm單晶置于Bruker Smart Apex CCD單晶衍射儀上, 用經石墨單色器單色化的Mo Kα射線(λ=0.071073 nm)在1.85°<θ<26.00°范圍內以φ~ω掃描方式于291(2)K下收集18 865個單晶衍射數據,4 831個獨立衍射點(Rint=0.023),其中I>2σ(I)的可觀察點3 655個。數據還原和解析分別用SMART和SHELXTL程序包[16]完成,晶體結構由直接法解出。對全部非氫原子坐標及其各向異性熱參數進行全矩陣較小二乘法修正,氫原子由理論加氫法得到,并進行各向同性精修。晶體學數據詳見表1。
表1 配合物1的晶體學數據
Table 1 Crystallographic data for 1

2 結果與討論
2.1 [Cu (L) (Phen )]·1/4H2O的晶體結構描述
配合物1的分子結構見圖1,主要鍵長及鍵角數據見表2。配合物1的配位單元是一個電中性分子,它由1個中心離子Cu(II)、1個鄰菲羅啉(Phen)和1個負二價的酰腙配體L2-組成。Cu(II)的配位數為5,與配原子形成畸變的四方錐配位幾何構型CuN3O2,其中2個N來自Phen,1個N來自酰腙配體的亞胺基,1個O來自酚鹽氧,1個O來自酰胺基(-CONH-),酰胺基烯醇化并脫除質子從而維持與金屬離子的電荷平衡。O1、O2、N2和N5位于錐底組成四邊形,N5-O1 -N2-O2扭轉角為4.06°,鍵角為80.86(11)~ 93.09(11)°和167.09(10)~ 171.02(12)°;N1位于錐頂,與鄰位原子組成的鍵角為77.65(11)~ 108.07(12)°。O1-C18-N4-N5-Cu1組成穩定的五元環,N5-C19-C20-C25-O2-Cu1組成穩定的六元環, Cu-O鍵長為0.1922(2)~ 0.1957(2) nm,Cu1-N5鍵長為0.1912(3) nm,都在正常范圍內,而N1-C12-C11-N2-Cu1組成穩定的五元環,Cu-N鍵長為0.2028(3)~ 0.2244(3) nm。
酰腙配體由于以烯醇式配位而使整個配體形成一個龐大的共軛體系,C14-C15-C18-N4 和C16-C15 -C18 -O1扭轉角分別為1.5(5)和1.3(5)°,C18-N4-N5-C19扭轉角為174.1(3)°,N5-C19-C20-C25扭轉角為-5.9(6)°,C26-N6-C23-C22和C28-N6-C23-C24扭轉角分別為3.1(5和7.0(5)°,吡啶環與苯環二面角約為13.5°。由于二乙胺基與苯環共軛,N6 -C23鍵長(0.1361(4) nm)呈現雙鍵特征,與吡啶環中C=N鍵長(0.1312(6)~ 0.1322(5) nm)相近。酚羥基脫質子配位后使氧原子O2的雜化軌道類型轉變為sp2,O2 -C25鍵長( 0.1305(4) nm)與雙鍵O1 -C18鍵長(0.1283(4) nm)接近,比游離配體[15]C-O鍵長 (0.1360(3) nm)短0.0055 nm。而共軛作用使C15 -C18 (0.1485(5) nm)和C19 -C20 (0.1415(6) nm)小于C-C單鍵鍵長。
Phen的所有原子幾乎完全共平面,相鄰配位單元的Phen的平面質心間距0.34508(5) nm,存在較強的π-π相互作用(圖2);同時Phen與另一分子的酰腙配體的苯環之間存在邊對面的C-H…π(0.24507 (3) nm)作用。于是,配位單元通過分子間的π-π作用和C-H…π作用聯接成一維鏈狀超分子。
表2 配合物1的主要鍵長及鍵角
Table 2 Select bond lengths(nm) and bond angles(°) for the 1
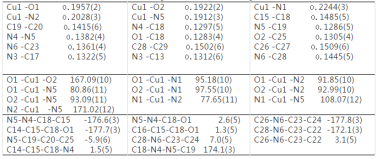
圖1 配合物1的分子結構圖的分子結構(橢球率30%)
Fig.1 The molecular structure of 1 at 30% probability
Cg1: C7/C8/C9/C10/N2/C11, Cg2: C20/C21/C22/C23/C24/C25
Cg1…Cg1#1: 0.34508(5) nm, C3#2-H3#2…Cg2: 0.24507 (3) nm
#1)1-x,2-y,1-z; #2)1-x,1-y,1-z
圖2 配合物1由 π…π和C-H…π作用構筑的一維超分子鏈
Fig.2 1-D chain supramolecule via π…π and C-H…π interactions in the 1
2.3 紅外光譜和電子光譜特征
酰腙配體H2L的IR中1677和1630 cm-1處的強吸收峰分別歸屬羰基和亞胺基的伸縮振動(n C=O和n C=N), 3161cm-1吸收峰來自酰胺基團N-H的伸縮振動(n NH),形成銅配合物后νC=O和νNH消失,說明酰腙以烯醇式配位,而亞胺基配位導致n C=N紅移至1589cm-1;酚羥基的Ar-O伸縮振動由1247 cm-1紅移至1246 cm-1;在配合物的IR中1428、828和723 cm-1一組新的吸收峰證明鄰菲羅啉參與配位。3400~3500 cm-1區域寬吸收峰屬結晶水的特征吸收。
以DMF為溶劑,配制5×10-6mol·dm-3的溶液,掃描得到的電子吸收光譜見圖3。酰腙配體H2L在268 nm的吸收帶屬π→π* 電子躍遷,375 nm屬n→π*電子躍遷和分子內電荷轉移躍遷(ILCT);形成銅配合物后,n→π*和ILCT電子躍遷紅移至416 nm,445 nm肩處的吸收可指認為配體與金屬之間的荷移躍遷(LMCT)。
配體:269, 377nm;配合物[Cu (L) (Phen )]·1/4H2O:273, 416, 445 nm(肩)
圖3 配體和銅配合物的紫外可見吸收光譜
Fig.3 UV-vis spectra of the ligand and copper(II) complex
2.4 熱穩定性
配體室溫至102℃失去1個結晶水,失重5.66%(理論值5.45%);278℃開始分解,278-345℃快速失重44.5%,700℃后恒重,殘重33.4%。配合物室溫至118℃失去結晶水,失重1.2%,(理論失重0.8%),337℃開始分解,337-359℃快速失重41.5%,可能與酰腙配體分解脫除苯環和吡啶片段有關(理論失重42.6%),之后緩慢持續失重,至800℃殘重37.9%,殘余物可能是金屬氧化物和部分積炭。
小編:wyf 05.19
![酰腙Schiff堿的[Cu(L)(Phen)]·1/4H2O (1)|(二乙胺基)水楊醛縮異煙酰腙/鄰菲羅啉銅配合物-UDP糖丨MOF丨金屬有機框架丨聚集誘導發光丨熒光標記推薦西安齊岳生物](/images/logo.png)



 齊岳微信公眾號
齊岳微信公眾號 官方微信
官方微信 庫存查詢
庫存查詢