黑磷納米片(BPNS),是一種生物兼容且可降解的二維納米材料。作為一種光熱劑,目前已被廣泛應用于前臨床**光熱**。但是,BPNS是一種對水-氧環(huán)境易感的材料,在體內(nèi)會快速被降解成磷氧化合物(PxOy), 從而失去光熱**性能。盡管目前已有多種通過對BPNS進行共價或者非共價的修飾方法被報道,基于此,對黑磷的光熱穩(wěn)定性進行改善,但是,這種改善是以損失**的降解性能作為代價。如何在不損失BPNS的降解性能的基礎(chǔ)上,能夠同時提升BPNS的光熱性能和**效果,是科學家追求的目標之一。
我們將二價金屬銅離子(Cu2+)與BPNS進行有機結(jié)合,實現(xiàn)了“一舉多得”的效果。該設(shè)計的優(yōu)勢主要表現(xiàn)為:
(1) BPNS可以**負載Cu2+;
(2)基于Cu的納米材料(如硫化銅納米顆粒)是良好的光熱劑,因此,BPNS 與 Cu 可以實現(xiàn)協(xié)同光熱作用,進一步提升光熱**性能;
(3)Cu(II) 可以與P(0) 發(fā)生氧化還原反應,從而促進BPNS的降解;
(4)反應生成的Cu(I)離子是一種類Fenton 反應催化劑,可以與**微環(huán)境中的H2O2發(fā)生反應,從而產(chǎn)生高濃度的?OH自由基,對**細胞進行殺傷,進而實現(xiàn)化學動力學**(Chemodynamic therapy)聯(lián)合的光熱**;
(5) Cu-64是一種常用的對納米藥物進行示蹤的正電子發(fā)射核素,可以用于正電子發(fā)射斷層掃描成像(PET)和β-線**,目前已用于多項臨床研究。
本設(shè)計中,通過對BPNS進行Cu-64標記,不會改變納米藥物的本來的結(jié)構(gòu),從而實現(xiàn)了對納米藥物的體內(nèi)動態(tài)和代謝的示蹤和反映。與傳統(tǒng)的光學成像(如近紅外,光聲成像)相比,具有可全身動態(tài)監(jiān)測,定量計算,臨床實踐零距離等多方面的優(yōu)勢,為未來基于BPNS的納米**的臨床轉(zhuǎn)化奠定了基礎(chǔ)。
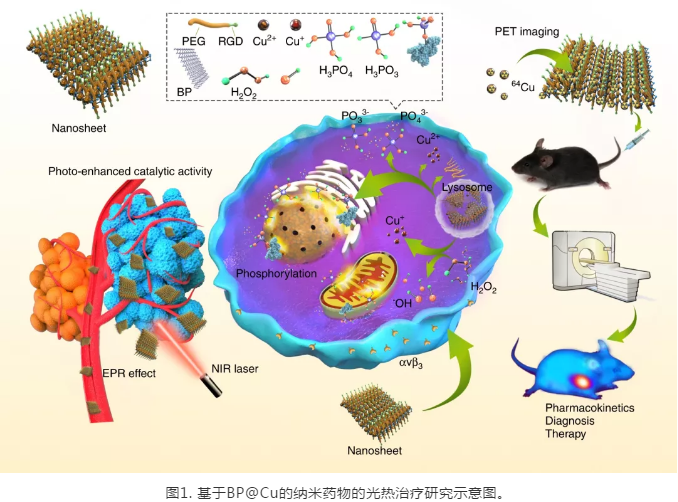
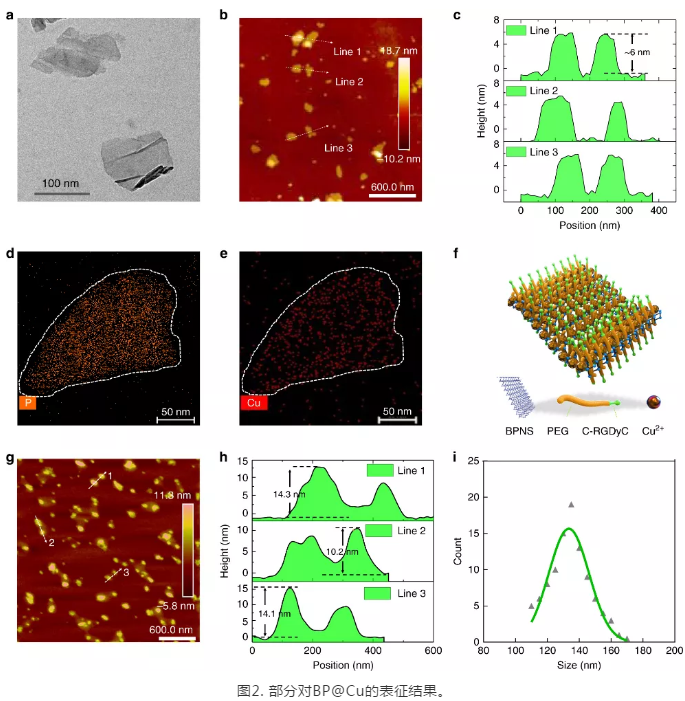
在實驗結(jié)果部分,**研究了BPNS與Cu(II)之間的相互作用,通過一系列表征手段,如TEM, AFM, UV-VIS-IR,Raman, XPS, EPR等,證實了BPNS 與 Cu(II) 發(fā)生了氧化還原反應,生成了Cu(I)。隨后,研究了BP@Cu 復合材料的光熱性能,結(jié)果表明:Cu(II)與BPNS 產(chǎn)生了光熱效果協(xié)同作用,在808 nm的激光照射下,BPNS@Cu釋放出更多的熱量。為了提升BP@Cu的體外穩(wěn)定性,進一步用PEG對BP@Cu進行了包裹,并在表面修飾了整聯(lián)素蛋白(integrin αvβ3)的靶向多肽(cyclo-RGD)。隨后,選取了多種**細胞對BP@Cu@PEG-RGD的生物學效應進行了評價。結(jié)果顯示:負載了Cu(II)的BPNS具有比BPNS更好的**細胞殺傷效果。在隨后細胞作用機制研究中,證實了BP@Cu誘導了**細胞內(nèi)更高的活性氧(ROS)水平,從而使**細胞發(fā)生凋亡和細胞周期**。
完整的體內(nèi)藥代動力學和代謝排泄途徑的研究,是納米藥物進行臨床實驗前不可缺少的重要一環(huán)。與其他納米藥物類似,BP@Cu@PEG-RGD 通過尾靜脈注射以后,會迅速被肝臟和脾臟吸收,但是隨著BPNS的緩慢降解,這些納米**的尺寸會逐步縮小,并**從脾臟和肝臟逃逸,重新進入血液循環(huán)。**隨著不斷降解,部分BPNS將會被腎臟-膀胱通路排出體內(nèi)。我們還考察了BP@Cu@PEG-RGD的**富集能力。在多種皮下**模型中,BP@Cu@PEG-RGD展現(xiàn)出在**組織的不斷累積作用,并在18小時左右達到最高點。這些結(jié)果為隨后施加光熱**和制定給藥方案提供了重要的參考。
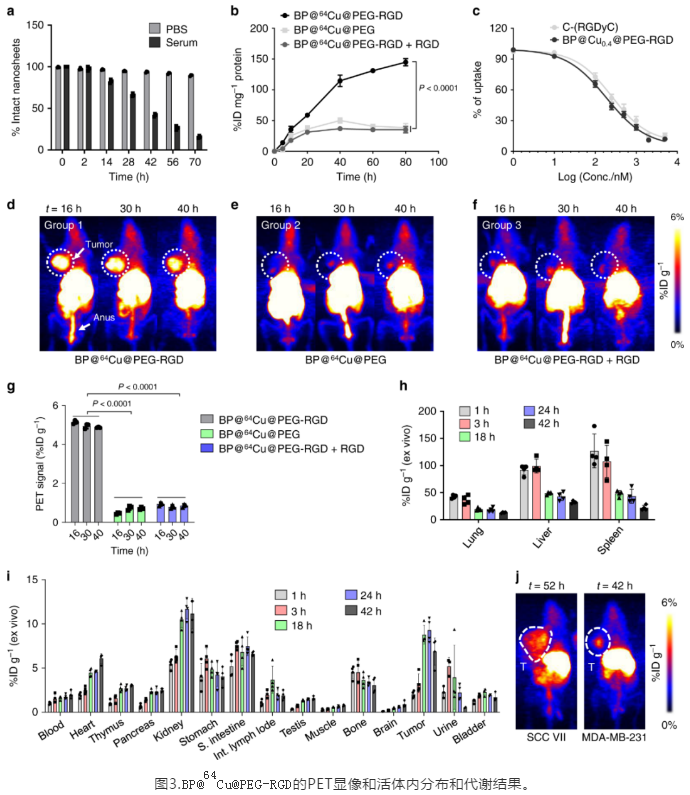
最后,研究BP@Cu納米藥物的****效果。結(jié)果表明,通過尾靜脈注射納米藥物,并在808 nm 激光的照射下,BP@Cu0.4@PEG-RGD **的**幾乎被完全**。形成鮮明對比的是,BP@Cu0.4以及BP@Cu0.4@PEG **的****效果不佳。這是由于BPNS 在**部位的富集主要是由RGD 介導。**,用PET評價了**效果,并進一步強調(diào)了PET作為診斷方法在納米**開發(fā)和**效果評價方面的重要作用。
西安齊岳生物提供定制黑磷納米復合材料的相關(guān)定制產(chǎn)品,現(xiàn)將產(chǎn)品目錄展示如下:
氮川三乙酸-鎳修飾黑磷納米片復合載藥材料NTA-NI-BPNSs
雷替曲塞修飾黑磷納米片復合載藥材料Raltitrexed-BPNSs
聚N-異丙基丙烯酰胺包裹黑磷量子點PNIPAAm-BPQDs
二硫鍵-聚乙烯亞胺包裹黑磷量子點PLA-SS-PEI-BPQDs
二苯基環(huán)辛炔功能化黑磷量子點DBCO-BPQDs
異硫氰基熒光素修飾黑磷納米片F(xiàn)ITC-PEG-BP
四甲基羅丹明聚乙二醇標記黑磷(BP)納米片TRITC-peg-BP




 齊岳微信公眾號
齊岳微信公眾號 官方微信
官方微信 庫存查詢
庫存查詢